|
Spis treści:
Czas geologiczny a paleontologiczne metody odtwarzania ewolucji - JERZY DZIK
DNA jako źródło informacji historycznej - ŁUKASZ PAŚKO
Zastosowanie danych paleontologicznych we współczesnej biologii - KENNETH A. MONSCH
Metoda największej wiarygodności - ucieczka ze strefy Felsensteina - KRZYSZTOF SPALIK
Filozofia rekonstrukcji historii organizmów - ANDRZEJ ELŻANOWSKI
Ciągły zapis ewolucji wczesnokredowego ślimaka - ANDRZEJ KAIM
Próba odtworzenia ewolucji rauizuchidów w związku z nowymi materiałami Teratosaurus sp. z Krasiejowa - TOMASZ SULEJ
Ewolucja kapitozaurów - DOROTA MAJER
Ewolucja metopozaurów - MAŁGORZATA BEDNARZ
Trendy w ewolucji fitozaurów - MARIUSZ LUBKA
Konwergencja w ewolucji małżów - MICHAŁ BRODACKI
Program Kursu
Sobota 11 maja 2002 roku
Miejsce: Instytut Zoologiczny UWr, ul. H. Sienkiewicza 21, Sala Kuntzego. Dojazd z dworca kolejowego Wrocław Główny tramwajem linii 8, 9, lub 17 (trzeba wsiąść na przystanku pl. Bema, na lewo od wyjścia głównego z Dworca, wysiąść na pierwszym przystanku za Odrą; ul. Sienkiewicza to pierwsza poprzeczna w prawo).
W czasie jednodniowej sesji wygłoszonych zostanie kilka wprowadzających wykładów (po 30 min.) z dyskusją (do 15 min.). W połowie sesji wykładowej planujemy krótką przerwę. Blok wykładów zakończy ogólna dyskusja dotycząca zagadnień w nich poruszonych. Prowokacją do sporów będzie, podobnie jak poprzednio, lista kontrowersji przygotowana głównie na podstawie streszczeń wystąpień dostarczonych przez prelegentów. Po przerwie obiadowej studenci i doktoranci przedstawią w krótkich wystąpieniach ewolucyjne aspekty swoich prac, co da podstawę do kolejnej dyskusji o metodach wnioskowania o przebiegu ewolucji.
Do dyspozycji prelegentów będzie rzutnik multimedialny, rzutnik slajdów i folii.
10.00 Otwarcie kursu
10.15. Jerzy Dzik: Czas geologiczny a paleontologiczne metody odtwarzania ewolucji.
11.00. Łukasz Paśko: DNA jako źródło informacji historycznej.
11.45. Kenneth Monsch: Zastosowanie danych paleontologicznych we współczesnej biologii.
12.30 Przerwa
12.45. Krzysztof Spalik: Maximum likelihood - ucieczka ze strefy Felsensteina.
13.30. Andrzej Elżanowski: Filozofia rekonstrukcji historii organizmów.
14.15. Ogólna dyskusja
14.45 Przerwa obiadowa
15.30. Andrzej Kaim: Ciągły zapis ewolucji wczesnokredowego ślimaka.
15.45. Małgorzata Bednarz: Ewolucja metopozaurów.
16.00. Mariusz Lubka: Trendy w ewolucji fitozaurów.
16.15. Dorota Majer: Ewolucja kapitozaurów.
16.30 Przerwa
16.45 Tomasz Sulej: Próba odtworzenia ewolucji rauizuchów w związku z nowymi danymi o teratozaurze z Krasiejowa.
17.00. Michał Brodacki: Konwergencja w ewolucji małżów.
17.15. Dyskusja podsumowująca i zamknięcie kursu.
Kurs jest otwarty dla wszystkich chętnych do udziału w nim. Prelegentom zwracamy koszty podróży i pobytu. Uczestnicy Kursu otrzymają kopię przewodnika.
Czas geologiczny a paleontologiczne metody odtwarzania ewolucji
JERZY DZIK
Instytut Paleobiologii PAN
W warstwach skalnych zapisany jest przebieg ewolucji świata żywego o bardzo rozmaitym stopniu kompletności, zależnej przede wszystkim od środowiska bytowania organizmów i podatności ich szczątków na skamienienie. Im dłuższego odcinka czasowego zapisu się domagamy, tym mniejsze szanse na jego znalezienie. Wynika to z samego sposobu powstawania skał osadowych, przy którym krótkie epizody formowania warstw rozdzielone są licznymi przerwami w sedymentacji. Nawet w sytuacji, gdy w skałach zawarty jest pełen zapis czasu geologicznego, szanse na przechowanie w nich dokumentów ewolucji nie są wielkie. Musiałyby też bowiem przez odpowiednio długi czas trwać warunki sprzyjające powstawaniu skamieniałości, te zaś są raczej wyjątkiem, niż stanem normalnym. Kiedy i ten warunek udaje się spełnić, przeszkodą dla badacza ewolucji stają się z reguły subtelne zmiany warunków środowiskowych, nie znajdujące odzwierciedlenia w osadzie, wystarczające jednak, by spowodować migracje gatunków i przerwać ciągłość ich bytowaniu w jednym miejscu. Mimo tych piętrowych serii trudności, przykłady pełnego zapisu ewolucji są dostatecznie liczne i reprezentatywne dla różnych środowisk, by zaświadczyć o tym, że tylko te czynniki są odpowiedzialne za jego niekompletność. Zresztą, jeśliby nawet ewolucja miała nieciągły charakter, nie dałoby się tego wykazać przy pomocy zapisu kopalnego, skoro sam jest z natury przerywany.
Założenia i metoda stratofenetyki
W rzadkich sytuacjach, kiedy zapis kopalny sprzyja badaczom, sposób postępowania wydaje się intuicyjnie oczywisty. Wystarczy nanieść na diagram ze skalą czasu ilościowy opis próbek wziętych z kolejnych warstw skalnych kompletnego profilu geologicznego. Jeśli serie próbek ukażą stopniowe przemiany anatomii organizmów o znaczącym zakresie, ewolucja ukazuje się jak na dłoni. Próbki sąsiadujące ze sobą parami nie różnią się wówczas od siebie, ale skrajne są do siebie zupełnie niepodobne. Nic dziwnego, że ta technika badawcza w mniej lub bardziej poprawnej postaci jest w użyciu od ponad półtora wieku. W 1979 roku została nazwana przez Philipa D. Gingericha stratofenetyką. Stratofenetyka, wbrew naturalnej nieciągłości zapisu kopalnego, pozwoliła na udokumentowanie ciągłych przemian ewolucyjnych obejmujących zakres przekształceń, który odpowiada konwencjonalnym różnicom między współwystępującymi rodzajami. Możliwe jest też odtwarzanie tą drogą ewolucji przebiegu ontogenezy, czy behawioru.
Na pozór działania prowadzące do stratofenetycznego odtwarzania przebiegu ewolucji są oparte na metodzie wnioskowania indukcyjnego: kumulowanie informacji o właściwościach i rozprzestrzenieniu próbek prowadzi do sformułowania teorii o przebiegu ewolucji w określonym wycinku drzewa rodowego. W rzeczywistości poprzedzone jest to złożonym rozumowaniem, choć znaczna jego część wykonywana jest w sposób rutynowy, nieuświadomiony. Metoda opiera się przecież na serii założeń mających swoje korzenie zarówno w geologii jak i biologii. Niezbędną podstawą jest geologiczna zasada superpozycji, z której wynika, że w niezaburzonym profilu geologicznym warstwa skały osadowej znajdująca się w górze jest młodsza od tej znajdującej się w dole. Ten fundament stratygrafii w geologii i archeologii jest w istocie dedukcją z twierdzenia, iż skała, w której znajdują się szczątki kopalne, jest skamieniałym osadem. Sama idea osadzania z zawiesiny implikuje przecież to, że pierwsze warstwy pozostają na dole. Drugie z fundamentalnych założeń paleontologii ewolucyjnej to wyprowadzone z biologii przypuszczenie, że jeśli skamieniałości w dwu warstwach sąsiadujących ze sobą w profilu geologicznym nie różnią się istotnie od siebie, to stanowią one część jednego ciągu genetycznego. Innymi słowy, to zlokalizowane geograficznie następstwo osobników pozostających ze sobą w związku przodek-potomek. Rozumowanie to jest prostym zastosowaniem do sytuacji kopalnej założenia o związku morfologii z genami. Założenia, bez którego nie byłoby do pomyślenia genetyka, choć wiemy, że stosunek między genomem a morfologią bywa w pewnych sytuacjach trudny do odcyfrowania.
Nie są to więc założenia specyficzne dla paleontologii. Zrozumiałe też jest, że wiarygodność tezy o identyczności morfologii i genetyki zmniejsza się nie tylko wraz z wzrastającą odległością geograficzną znalezisk (jak jest i w neontologii), lecz także wraz ze wzrastającą odległością czasową między próbkami. Im większe i bardziej informatywne podobieństwo, tym większe odległości czasoprzestrzenne jest w stanie znieść hipoteza o związku genetycznym (czyli ewolucyjnym) organizmów. Obserwacja ta pozwala na płynne przejście od sytuacji nienormalnej, jaką jest pełen zapis kopalny pozwalający na zastosowanie metody stratofenetyki, do sytuacji zwyczajnej, czyli zapisu bardzo niekompletnego. Jednakie jest więc metodologiczne podejście do zapisu kopalnego jakiejkolwiek postaci. W każdej sytuacji, jeśli uwzględnione jest następstwo czasowe znalezisk, sposób postępowania jest ten sam. Jest to metoda chronofiletyki.
Metodologicznymi fundamentami tej metody jest formułowanie hipotez ewolucyjnych przodek-potomek (opatrzonych zatem strzałką czasu) i testowanie ich wstecz osi czasowej, czyli w drodze retrodykcji.
Retrodykcja i testowanie hipotez o przebiegu ewolucji
Ewolucję śledzi się wstecz osi czasu, a nie przewiduje jej późniejszego przebiegu. Jest wiele powodów, dla których nie jest możliwe przewidywanie ewolucji. Powodem oczywistym i wystarczającym jest techniczna niemożność testowania takich hipotez. Z każdego osobnika powstać może bowiem w krótkim czasie niezliczona liczba ciągów genealogicznych, a z każdego gatunku niezliczona liczba linii rozwojowych. Nawet znalezienie zapisu kopalnego sprzecznego z oczekiwaniami dotyczącymi znacznej części linii nie daje możliwości wykluczenia, że postulowany rezultat ewolucji jest mimo to prawdziwy, a jedynie nie został dotąd udokumentowany. Szczęśliwie dla nas, tak osobnik bezpłciowego organizmu jak i gatunek biologiczny mogą mieć tylko jednego bezposredniego przodka swojej rangi. Jakiekolwiek odmienne interpretacje ewolucyjnego pochodzenia określonego gatunku są więc ze sobą sprzeczne. Tylko jedna z nich może być prawdziwa. Uprawdopodobnienie jednej z hipotez to zmniejszenie wiarygodności wszystkich pozostałych. Wykazanie jej prawdziwości oznacza ostateczne obalenie pozostałych. Jest to jednak możliwe tylko pod warunkiem prowadzenia rozumowania wstecz osi czasu, czyli drogą retrodykcji (postdykcji).
Do zobrazowania, o co chodzi, posłużyć się można przykładem niegdyś uznawanej hipotezy, że żyjąca w Afryce populacja australopiteków sprzed ponad półtora miliona lat temu, umownie klasyfikowana jako Australopithecus robustus,, jest przodkiem dzisiejszego człowieka. Prześledzenie naszej ewolucji wstecz po osi czasu, od dzisiejszego rozległego rozprzestrzenienia przez subtropikalne azjatycko-afrykańskie populacje określane jako Homo erectus do populacji afrykańskich nazywanych Homo ergaster, a wreszcie do Homo habilis wyklucza prawdziwość tej hipotezy, czyli w istocie ją falsyfikuje. Jest tak, bowiem H. habilis współwystępował sympatrycznie z A. robustus. O ile były to izolowane genetycznie biologiczne gatunki, tylko jeden z nich mógł być naszym przodkiem. Procedura ta składała się z serii hipotez o związku przodek-potomek, każda z nich osobno wymagających testowania. Granica, do której hipotezę o takim związku wystarczy doprowadzić, to układ dwu sąsiednich czasowo populacji żyjących w tym samych rejonie, które nie różnią się od siebie anatomiczne. Wówczas osiąga się poziom pewności uwarunkowany tylko prawdziwością przyjętych na początku założeń paleontologii ewolucyjnej.
Nie jest istotne, że dowody takie rzadko udaje się przeprowadzić do końca. Nie byłoby zresztą technicznie możliwe przestudiowanie w ten sposób (czy w jakikolwiek inny) milionów potencjalnie możliwych hipotez o przebiegu ewolucji poszczególnych linii gatunkowych. Z tego samego powodu, który czyni nierealnym oczekiwanie, że test krzyżowania zostanie przeprowadzony w odniesieniu do każdego z milionów dzisiejszych gatunków znanych jedynie na podstawie wypchanych skórek czy zasuszonych liści w zbiorach muzealnych. Ważne, że istnieje potencjalna możliwość falsyfikacji twierdzeń o przebiegu ewolucji przy użyciu bezpośrednio pozyskanych danych empirycznych. Chodzi o testowalność tego rodzaju hipotez jako ich istotną cechę. Testowalność dotyczy hipotez opisujących stosunek przodek-potomek. Jest to rodzaj przedstawiania rezultatów ewolucji radykalnie odmienny od wszelkich metod wnioskowania opartych na pokrewieństwie w ścisłym tego słowa znaczeniu (czyli podobieństwie krwi szacowanym na podstawie morfofizjologii, bez włączania do tego czasu geologicznego).
Chronofiletyka
Sposób formułowania hipotez o przebiegu ewolucji (filogenetycznych) ma więc fundamentalne znaczenie z punktu widzenia metodologii nauki. Zależnie od tego przebieg ewolucji może być przedmiotem badań naukowych lub jedynie nietestowalnych narracji. Hipotezy ewolucyjne powinny mieć taką postać, by możliwe było ich testowanie przy pomocy danych empirycznych, czyli danych o zmianach anatomii w czasoprzestrzennych koordynatach wywnioskowanych ze skamieniałości. Z tego punktu widzenia nie są istotne nazwy, ani klasyfikacja. Przecież nawet w przypadku oczywistej ciągłości następstwa próbek paleontolodzy zwykle nadają poszczególnym populacjom osobne nazwy, choć w ciągach takich nie ma zjawiska formowania gatunków, czyli specjacji. Nie o arbitralne decyzje nomenklatoryczne chodzi, lecz wnioski co do natury przemian anatomicznych, ich następstwa w czasie geologicznym i lokalizacji geograficznej.
Podstawą wnioskowań o przebiegu ewolucji w paleontologii są w każdym przypadku populacje kopalne. Nie konstrukcje teoretyczne powstałe w umysłach badaczy (czyli taksony), lecz obiektywne byty istniejące w określonych miejscach czasoprzestrzeni. By miejsca te precyzyjnie określić, populacje powinny być reprezentowane przez próbki z możliwie wąsko geograficznie ograniczonych stanowisk kopalnych, co pozwala uniknąć mięszania populacji o różnych cechach, i z warstw skalnych osadzonych w możliwie wąskim przedziale czasu geologicznego. Na tyle krótkim, by nie obejmował znaczących zmian ewolucyjnych. Nierzadko populacje kopalne są zresztą reprezentowane przez pojedyncze osobniki, co usuwa problemy z określeniem ich koordynat czasoprzestrzennych. Zarówno hipoteza o istnieniu wyodrębnionej genetycznie populacji kopalnej jak hipoteza ewolucyjna przodek-potomek są więc prezentacją ewolucji pojmowanej jako proces fizyczny: populacja daje opis jego chwilowego stanu.
Z gruntu odmienną naturę metodologiczną mają wydzielenia taksonów i oszacowywanie stopnia pokrewieństwa krwi między nimi. Same taksony są mniej lub bardziej subiektywnymi zgrupowaniami danych o gatunkach. Również ich zasięgi czasowe są subiektywnie określane i stale się zmieniają w miarę dopływu danych i zmian interpretacji (np. w wyniku definiowania cech morfologicznych).
Formułując hipotezę przodek-potomek w oparciu o jakikolwiek rodzaj zapisu kopalnego stosuje się zasady jednakie dla wszystkich organizmów. Jednym z podstawowych kryteriów wartości hipotez jest łatwość ich falsyfikacji, a ta jest paradoksalnie tym większa, im uboższy jest zapis kopalny. Wystarcza wówczas pojedyncze znalezisko, by radykalnie zmienić naświetlenie zagadnienia. Archaeopteryx, przedstawiciel grupy o do niedawna bardzo ubogim zapisie kopalnym, jest tego dobrą ilustracją.
Chronofiletyka umożliwiła identyfikację nader kompletnych serii przejść morfologicznych. Postęp badań pozwala na stopniowe łączenie ze sobą coraz większej liczby całych gromad i typów świata zwierzęcego i roślinnego. W coraz większej liczbie serii hipotez przodek-potomek przeskoki dochodzą do poziomu konwencjonalnych różnic między rodzajami w obrębie jednej rodziny. W zasadzie nie ma w tej dziedzinie ograniczeń a priori wynikających z natury materiału paleontologicznego. Metoda ta w równym stopniu jest stosowalna do amonitów, co żebropławów. Odmienne pozostają jedynie szanse na korroborację hipotez.
Analiza cech w paleontologii
W zapisie stratofenetycznym nie ma miejsca na specjacje. Gdyby się nawet odbywały, w pojedynczych profilach geologicznych są nierozpoznawalne. Nie da się ich zidentyfikować, bo najwyraźniej nie ma związku między tempem ewolucji a rozdzielaniem się dróg ewolucji. Nie ma więc żadnego powodu do twierdzenia, że specjacja jest niezbywalnym atrybutem ewolucji. Formowanie się gatunków cechuje przecież jedynie organizmy intensywnie wymieniające informację genetyczną. Gatunek jest ubocznym produktem ewolucyjnej inwencji płci. Co więcej, nie ma mocnych argumentów na rzecz tezy, że istnienie gatunku istotnie wpływa na charakter i tempo ewolucji. Te spośród organizmów wyższych, które wtórnie zrezygnowały z procesów płciowych, ewoluowały mimo to wcale efektywnie. Nie gorzej od swoich płciowych krewniaków.
Zagadnienie specjacji to zatem przedmiot opisu nie tyle teorii ewolucji, co teorii zjawisk płciowych i teorii ekologicznych dotyczących formowania barier reprodukcyjnych. Ewolucja nie wymaga koniecznie płci ani specjacji. Może się odbywać po prostu w genealogicznych ciągach osobniczych - tak ewoluują prokarioty i organizmy wtórnie bezpłciowe. Często ma miejsce w ogromnych panmiktycznych populacjach nie podlegających rozdziałowi na osobne linie gatunkowe. Gdyby nie niejednorodność środowiska, gatunków mogłoby nie być. Specjacja jest więc na gruncie paleontologii zagadnieniem podrzędnej wagi. Ani odmienności morfologii pomiędzy różnymi geograficznie populacjami nie są przecież dowodem odrębności gatunkowej, ani też ich nierozróżnialność morfologiczna nie musi oznaczać identyczności gatunkowej. Sytuacja współwystępowania nierozpoznawalnych gatunków bliźniaczych oznacza w praktyce jedynie to, że moment pojawienia się bariery genetycznej identyfikowany bywa z pewnym opóźnieniem. Trzeba czasu, by skumulowały się i ujawniły odmienności morfologiczne między nimi.
Skutki rozbieżnej natury ewolucji, czy to w sytuacji prawie zupełnego braku horyzontalnej wymiany genów, czy tylko częściowego jej ograniczenia (specjacji) są jednak ważnym i wielu przypadkach (w szczególności organizmów dzisiejszych) niezastąpionym źródłem informacji o jej przebiegu. Założenia metod wnioskowania o przebiegu ewolucji ze zróżnicowania współwystępujących organizmów są dogłębnie odmienne od założeń pozwalających na wnioskowanie w kategoriach hipotez przodek-potomek. By wykorzystać ten rodzaj informacji trzeba przede wszystkim przyjąć, że istnieje korespondencja pomiędzy odmiennością poszczególnych organizmów a czasem, który upłynął od rozdzielenia się dróg ich ewolucji. Jeśli z różnic anatomicznych wyprowadzić się chce następstwo czasowe ich powstawania, procedurę należy prowadzić osobno dla danych z każdego horyzontu czasowego. W przeciwnym przypadku grozi błędne koło w rozumowaniu przez wprowadzanie do wyjściowej macierzy danych informacji odpowiadajacych raczej oczekiwanym skutkom rozumowania. Poza tym z morfologii mamy przecież wywnioskować następstwo czasowe, a obiektywne różnice wieku między formacjami geologicznymi już ten wymiar a priori wprowadzają.
Przy tym prostym i dość oczywistym założeniu, używając którejkolwiek z dostępnych metod analizy danych stworzyć można drzewkowaty diagram, który pokaże hierarchię rozgałęzień dróg ewolucji, które doprowadziły do stanu dzisiejszego. Jeśli będzie to metoda porównywania zgodności cech pomiędzy organizmami (fenetyka), diagram da się wyskalować w jednostkach podobieństwa. Jeśli przeprowadzi się analizę rozprzestrzenienia cech (kladystyczną), poszczególnym węzłom diagramu przypisać można kolejne pojawianie się specyficznych innowacji ewolucyjnych (synapomorfii). To ostatnie oznacza ukorzenienie diagramu, co wymaga wprowadzenia dodatkowych, bardziej szczegółowych i zwykle ryzykownych założeń. Było niegdyś przyjęte np. że tempo ewolucji całych organizmów jest zmienne, czyli że prostota anatomiczna jest z natury wyrazem pierwotności ewolucyjnej. Pozostało założenie mniej ryzykowne, że tylko poszczególne cechy organizmów wykazują zróżnicowane tempo ewolucji. Bywają też w użyciu założenia jawnie fałszywe, jak wyłącznie dychotomiczny charakter ewolucji, czy o koncentracji zmian w momencie specjacji.
Rzecz jasna, możliwa jest ogromna liczba odmiennych dendrogramów pokrewieństw opartych na tych samych macierzach danych. Z zasady wybiera się te z nich, które są najbardziej oszczędne, jeśli idzie o liczbę niezbędnych ewolucyjnych zmian morfofizjologii. Jest to zastosowanie fundamentu metody naukowej czyli zasady oszczędności w kreowaniu bytów (brzytwy Occama; parsymonii). Choć ewolucja nie zawsze idzie najprostszą drogą od zasady tej nie ma ucieczki, jeśli chce się pozostać na gruncie nauki. Podobnie, jak od zasady testowalności twierdzeń naukowych. Pewną formą uwiarygodniania diagramów pokrewieństw jest porównywanie między sobą rezultatów analizy różnych zestawów cech w poszukiwaniu zgodności (kongruencji), w szczególności przez rozszerzanie macierzy danych. Nie jest to jednak testowanie w rozumieniu metody nauki, a jedynie kolejne zastosowanie zasady parsymonii. Rzeczywiste testowanie (w szczególności falsyfikacja) wymaga takiego sformułowania teorii o kształcie ewolucji, by opisywała realnie przebiegający proces fizyczny. Wówczas możliwe jest skonfrontowanie dedukcji wynikających z zastosowania teorii z obserwacjami bezpośrednio odnoszącymi się do tego procesu. Oznacza to zatem konieczność uwzględnienia czasowego wymiaru ewolucji, czyli (jak to nazwane zostało w 1979 roku przez Nielsa Eldredge'a, w intencji ironicznie) scenariusza ewolucyjnego.
Tylko narracyjny opis ewolucji może być bezpośrednio skonfrontowany z czasowym następstwem form obserwowanym w zapisie kopalnym. To pole stykania się ze sobą obszarów badań ewolucji opartych na metodach filogenetyki (molekularnej czy morfologicznej) i chronofiletyki (bezpośrednio odwołującej się do materiału kopalnego). Jeśli drzewa rodowe przygotowywane przez badaczy organizmów dzisiejszych mają być skutecznie testowane przez paleontologów, powinny łatwo dać się przekształcać w scenariusze. Postulat ten zbyt rzadko jest spełniany.
DNA jako źródło informacji historycznej
ŁUKASZ PAŚKO
Uniwersytet Wrocławski
Zawartość informacyjna DNA oznacza co innego dla genetyka (informacja genetyczna) i filogenetyka (informacja historyczna). Informacja historyczna stanowi zapis przebiegu ewolucji linii filogenetycznych (bezwzględny wiek powstania danych taksonów, ich względne następstwo odgałęziania się i kumulacja ich cech specyficznych wzdłuż ramion drzewa ewolucyjnego) (Nei & Kumar 2000). Informacja o przebiegu ewolucji jest zawarta w (1) sekwencji nukleotydów danego fragmentu DNA, zmienianej przez substytucje i niewielkie mutacje indel, oraz w (2) organizacji genomu, która podlega tzw. rzadkim zmianom genomowym (Rokas & Holland 2000). Takimi markerami ewolucji są insercje i delecje intronów, retrotranspozony, sekwencje sygnaturowe, warianty kodu genetycznego, kolejność genów czy duplikacje genów. Klasyczna filogenetyka molekularna oparta na DNA wykorzystuje jednak najczęściej informację zawartą w sekwencji nukleotydów (i do niej odnosi się dalsza część tekstu). Informacja historyczna zawarta w DNA stanowi zapis przebiegu ewolucji zarówno konkretnej sekwencji, jak i "posiadających" ją taksonów. Ponieważ sekwencje DNA ściśle odtwarzają tylko własną ewolucję, a filogenetyka i paleobiologa interesuje raczej historia grup organizmów, stąd konieczność przełożenia losów sekwencji na losy gatunków (problem: drzewo genów vs. drzewo gatunków - Doyle 1996).
Zawartość informacji w DNA
Przydatność fragmentu DNA do badań filogenezy zależy od tempa jego ewolucji (liczby substytucji czyli podstawień na jednostkę czasu na pozycję). Jeżeli tempo ewolucji jest zbyt wolne, to w interesującym nas przedziale czasowym nagromadziło się zbyt mało różniących się pozycji nukleotydowych (wśród których mogą być informacyjne filogenetycznie). Jeżeli tempo jest zbyt szybkie, to nastąpiło nasycenie mutacjami (wielokrotne, zastępujące się, mutacje na tej samej pozycji). Informacja o rzeczywistej liczbie zmian mutacyjnych (ewolucji), jaką przeszła dana sekwencja, została zamazana przez nałożenie mutacji. Ponadto, jeżeli tempo było zbyt szybkie, doszło zapewne do nagromadzenia homoplazji (rewersji, paralelizmów i konwergencji).
Ponieważ istnieją tylko cztery nukleotydy (czyli stany cechy: A, G, C, T) to prawdopodobieństwo powrotu (fig. 1) do stanu przed mutacją (ryc. 1: pozycje 2 i 1) wynosi aż 0.33(3), przy założeniu równego prawdopodobieństwa wszystkich substytucji. Stąd w przypadku DNA istnieje większe prawdopodobieństwo homoplazji niż w przypadku cech morfologicznych. Szczególnie użyteczne do celów filogenetycznych są sekwencje, które od czasu dywergencji linii ewolucyjnych nabyły wiele mutacji, ale jeszcze nie przekroczyły "granicy", za którą wzrasta liczba mutacji nasycających.
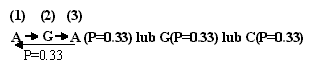 | | Ryc. 1. Prawdopodobieństwo zajścia substytucji powodujących homoplazje. |
Identyfikacja genów o optymalnym udziale mutacji nasycających. - Ogólna procentowa odmienność sekwencji między taksonami nie jest wystarczającą miarą ich przydatności do konkretnego zadania filogenetycznego. Łączy ona efekt działania kilku zmiennych komponentów składających się na tempo i charakter ewolucji sekwencji.
Najważniejsze z nich (Graybeal 1994) to (1) tempo substytucji na poszczególnych pozycjach, (2) proporcja pozycji, które mogą podlegać substytucjom i (3) rodzaje substytucji. Gen o małej ogólnej procentowej odmienności sekwencji może mieć dużo wolno ewoluujących pozycji - jest więc użyteczny do badania głębokich dywergencji (ryc. 2: gen 2). Może mieć jednak niewiele pozycji, ale szybko ewoluujących - jest wtedy użyteczny do badania niedawnych dywergencji (ryc. 2: gen 1). Taka sama ogólna różnica może więc charakteryzować geny o różnym charakterze ewolucji (miejsca przecięcia krzywych). Bardziej szczegółowo przydatność genu określają (1) charakter krzywej, wzdłuż której przebiega jego dywergencja i (2) stopień nachylenia krzywej w punkcie odpowiadającym szacowanemu czasowi dywergencji badanych taksonów (ryc. 2). Im krzywa jest bardziej zbliżona do linii prostej, tym większe prawdopodobieństwo, że sekwencje nie weszły jeszcze w etap wzrostu mutacji nasycających. Wiarygodne będą zatem wnioskowania związane z zegarem molekularnym. Im nachylenie krzywej większe, tym większe prawdopodobieństwo, że sekwencje nie weszły jeszcze w etap wzrostu mutacji nasycających i tym więcej mają różniących się od siebie pozycji.
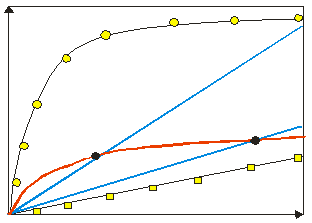 | Ryc. 2. Przykładowe krzywe ewolucji genów: gen 1 i gen 2 - opis w tekście, gen 3 zawiera dużą liczbę umiarkowanie szybko ewoluujących pozycji, gen 4a i 4b - ewolucja hipotetycznego genu rozdzielona na synonimiczne (4b, kółka) i niesynonimiczne (4a, kwadraty) substytucje, 4a - duża liczba bardzo wolno ewoluujących niesynonimicznych pozycji, 4b - duża liczba bardzo szybko ewoluujących synonimicznych pozycji. |
Branie pod uwagę tylko procentu różnic może być niewystarczajace do wyboru między dwoma sekwencjami (ryc. 2: krzywe 1 i 2). Uwzględnienie wspomnianych parametrów krzywej pozwala wybrać optymalną sekwencję. Tempo ewolucji poszczególnych pozycji i prawdopodobieństwo zajścia określonych podstawień jest w rzeczywistości bardzo zmienne, w skrajnym przypadku każda pozycja danego genu może mieć swoje indywidualne tempo ewolucji. Jeszcze bardziej precyzyjna ocena zawartości informacyjnej sekwencji wymaga rozróżnienia między tymi pozycjami i typami ich zmian, czyli rozpatrywania klas różnic między sekwencjami (Naylor et al. 1997). Najczęściej rozpoznawanymi klasami substytucji są transwersje vs. tranzycje, substytucje na pozycjach należących do różnych domen, substytucje synonimiczne vs. niesynonimiczne (dla genów kodujących białka - ryc. 2).
Zegar molekularny
Koncepcja zegara molekularnego, wprowadzona przez Zuckerkandla i Paulinga w 1962 roku, jest jedną z najbardziej spektakularnych i zaskakujących konsekwencji filogenetyki molekularnej. Tempo mutacji DNA jest w określonych sytuacjach w przybliżeniu stałe. Podstawą koncepcji zegara molekularnego jest jednak stwierdzenie, że również w przybliżeniu stałe jest tempo utrwalania się tych mutacji w trakcie czasu ewolucyjnego. To stwierdzenie ma sens jednak tylko przy rozpatrywaniu zbliżonych taksonów i zbliżonych genów.
Wiadomo dzisiaj, że nie istnieje uniwersalny zegar molekularny (Stepien & Kocher 1997). Istnieją tylko zegary lokalne. Idea zegara molekularnego wynika z teorii neutralnej ewolucji Kimury (lub teorii prawie neutralnej ewolucji). Według jej przewidywań k = 2Nľu, gdzie k - tempo utrwalania substytucji na pozycję nukleotydową na rok, 2N - rozmiar diploidalnej populacji, ľ - liczba pojawiających się substytucji na rok, u - prawdopodobieństwo ich utrwalenia się. Gdy ewolucja molekuły jest neutralna to u = 1/2N, czyli prawdopodobieństwo utrwalenia się mutacji jest tym większe, im mniejszy rozmiar populacji. Po kompilacji tych dwóch formuł i prostej redukcji wyrażeń otrzymujemy k = ľ. Jest to jedna z najważniejszych formuł ewolucji molekularnej. Mówi ona, że tempo utrwalania neutralnych substytucji zależy tylko i wyłącznie od ich tempa pojawiania się. Liczba mutacji która pojawia się w tym samym genie i w różnych liniach ewolucyjnych od momentu ich filogenetycznego rozłączenia jest w przybliżeniu (proces stochastyczny) taka sama. Użyteczne jest więc jej przeskalowanie na czas chronologiczny aby uzyskać informację na temat bezwzględnego czasu powstania i ewolucji badanych taksonów. Ten proces to kalibracja zegara molekularnego. Dokonuje jej się na dwa podstawowe sposoby (Hillis et al. 1996): (1) przez porównanie z wiarygodnie datowanym zapisem kopalnym (ryc. 3), (2) przez porównanie z wiarygodnie datowanymi wydarzeniami geologicznymi (ryc. 4).
 | | Ryc. 3. Czasy dywergencji oparte na materiale kopalnym i często stosowane w kalibracjach zegara molekularnego (Graybeal 1994). |
Kalibrowanie paleontologiczne jest często praktykowane, jest jednak obciążane istotnym błędem (ryc. 4). Po pierwsze, dokładne datowania zdarzenia dywergencji wymaga dobrze datowane skamieniałości dokumentujących obie powstałe wówczas linie możliwie blisko zdarzenia (ryc. 4a). Zwykle skamieniałości nie reprezentują bezpośrednich przodków, lecz boczne linie, które oddzieliły się przed i po zdarzeniu. Z zasady oznacza to niedoszacowanie czasu dywergencji (ryc. 4b) (Hillis et al. 1996), tym bardziej, że taksony potomne są znajdowane na ogół powyżej warstw, które powstały w czasie dywergencji (ryc. 4c) (Stepien & Kocher 1997).
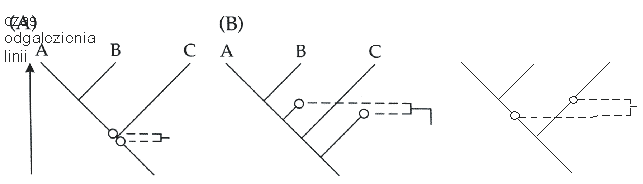 | | Ryc. 4. źródła błędu w paleontologicznej kalibracji zegara molekularnego. |
Kalibracja geologiczna polega na znalezieniu takiej dywergencji prowadzącej do dwóch linii ewolucyjnych o znanej i równej liczbie substytucji, dla której znane jest dobrze datowane wydarzenie geologiczne, które tę dywergencję spowodowało.
| Tab. 1. Przykłady dobrze datowanych wydarzeń geologicznych używanych często do kalibracji zegara molekularnego (wg. Nei i Kumar 2000). |  | |
Wykalibrowanie czasowe zegara pozwala dokonywać oszacowań czasów dywergencji niedatowanych paleontologicznie, z uwzględnienieniem wpływu błędu stochastycznego (ryc. 5). Dokonuje się tego poprzez wyznaczenie 95% przedziału ufności, np. przy założeniu, że rozkład Poissona opisuje prawdopodobieństwo gromadzenia się substytucji (zgodnie z założeniem teorii ewolucji neutralnej).
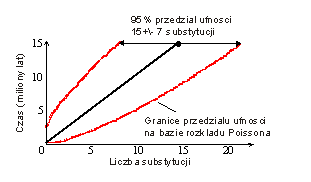 | Fig. 5. Wpływ błędu stochastycznego na oszacowania zegara molekularnego przy założeniu gromadzenia się mutacji zgodnie z rozkładem Poissona i kalibracją 1 substytucja na 1 Myr (Hillis et al. 1996). |
Wydobywanie informacji historycznej z DNA
W procesie tym można wyróżnić (1) etap polegający na znalezieniu i homologizacji potencjalnych cech systematycznych (czego dotyczy dalsza część tekstu) oraz (2) część poświęconą stricte analizie filogenetycznej tak rozpoznanych cech.
Homologizacja sekwencji. - Pierwszym etapem każdej analizy filogentycznej jest identyfikacja cech homologicznych. W przypadku DNA są nimi odpowiadające sobie sekwencje DNA (geny, fragmenty genów). Są trzy podstawowe rodzaje homologii: ortologia, paralogia i xenologia (ryc. 6). Ortologi to odpowiadające sobie loci z różnych organizmów (allele), powstają wraz ze specjacją lub polimorfizmem (np. płciowym) populacji. Paralogi są efektem duplikacji genów w tym samym organizmie. Xenologi są rezultatem horyzontalnego transferu genów. Tylko historia ortologów jest więc skorelowana z wydarzeniami specjacyjnymi (Page & Holmes 1998).
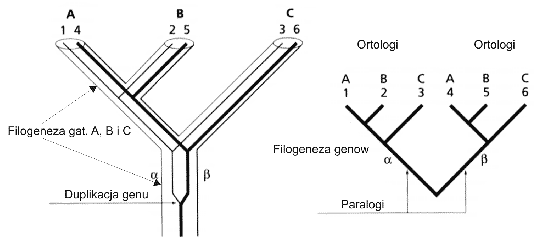 | | Fig. 6. Homologie genów. Duplikacja prowadzi do powstania dwóch paralogicznych linii ewolucyjnych genu, z których każda różnicuje się na trzy geny ortologiczne (1-3 i 4-6). |
Homologizacja pozycji, czyli dopasowywanie sekwencji. - Uzyskane sekwencje ortologicznych fragmentów DNA wymagają dopasowania czyli ustalenia, które pozycje nukleotydowe są sobie homologiczne. Dopasowanie (alignment) może dotyczyć równocześnie dwóch (pairwise alignment) lub wielu sekwencji (multiple alignment). Polega ono na takim założeniu homologii pozycji w danych sekwencjach, aby liczba zakładanych substytucji i przerw na odpowiadających sobie pozycjach nukleotydowych była jak najmniejsza (jest to tzw. koszt dopasowania sekwencji - ryc. 7). Poszczególne rodzaje substytucji (np. tranzycje i transwersje) oraz mutacje indel (przerwy w dopasowywanych sekwencjach) mogą być różnie ważone ze względu na swój udział w kosztach dopasowania. Tranzycje mają na ogół mniejszą wagę (wkład w koszty) niż transwersje, ponieważ zdarzają się częściej. Przerwy wymagające mutacji indel mają na ogół większą wagę niż substytucje i może być ona różna zależnie od długości zakładanej przerwy.
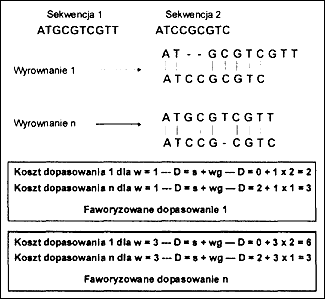 | | Ryc. 7. Przykład dopasowania dwóch prostych sekwencji i obliczenia jego kosztów. D - koszt dopasowania, w - waga nadana zakładanej przerwie w sekwencji, g - długość przerw, s - liczba zakładanych substytucji |
Najprostszym sposobem dopasowania wielu sekwencji równocześnie jest minimalizacja sumy kosztów wszystkich dopasowań podwójnych (pairwise alignment). Dopasowanie sekwencji coraz częściej jest uznawane nie za etap wstępny do analiz filogenetycznych ale za ich integralną część - oszczędnościowa definicja cech (Phillips et al. 2000).
Literatura
Doyle, J. 1996. Homoplasy connections and disconnections: Genes and species, molecules and morphology. In: M. Sanderson & L. Hufford (eds) Homoplasy. 000 pp. Academic Press.
Graybeal, A. 1994. Evaluating the phylogenetic utility of genes: A search for genes informative about deep divergences among vertebrates. Systematic Biology 43, 174-193.
Hillis, D., Mable, B. & Moritz, C. 1996. Applications of molecular systematics. In: D.Hillis, C. Moritz, & B. Mable (eds) Molecular Systematics. 000 pp. Sinauer Associates, Inc.
Naylor, G, Martin, A., Mattison, E. & Brown, W. 1997. Interrelationships of lamniform sharks: testing phylogenetic hypotheses with sequence data. In: C. Stepien & T. Kocher (eds) Molecular Systematics of Fishes, 197-218. Academic Press.
Nei, M. & Kumar, S. 2000. Molecular Evolution and Phylogenetics. 000 pp. Oxford University Press.
Page, R. & Holmes, E. 1998. Molecular Evolution. A Phylogenetic Approach. 000 pp. Blackwell Science.
Phillips, A., Janies, D. & Wheeler, W. 2000. Multiple sequence alignment in phylogenetic analysis. Molecular Phylogenetics and Evolution 16, 317-330.
Rokas, A. & Holland, P. 2000. Rare genomic changes as a tool for phylogenetics. TREE 15, 454-459.
Stepien, C. & Kocher, T. 1997. Molecules and morphology in studies of fish evolution. In: C. Stepien & T. Kocher (eds) Molecular Systematics of Fishes, 1-12. Academic Press.
Zastosowanie danych paleontologicznych we współczesnej biologii
KENNETH A. MONSCH
Uniwersytet Wrocławski
Przedstawię rzadko w pełni rozumiane znaczenie paleontologii jako nauki.
Rola paleontologii w badaniach ewolucji
Historia życia świata. - 'Ogólnym celem paleontologii jest postrzeganie ewolucji przez pryzmat czasu' (Smith, 1994). Całe zastosowanie danych paleontologicznych jest oparte na tym stwierdzeniu. Skamieniałości są jedynym świadectwem wymarłych organizmów z czasów prehistorycznych.
Filogeneza dzisiejszych organizmów.- Do końca lat osiemdziesiątych sądzono że skamieniałości nie są dość kompletne, że brak im zbyt wielu ważnych elementów, by ich używać razem z ich dzisiejszymi krewnymi do rekonstruowania filogenezy organizmów. Jednak eksperymenty kladystyczne zademonstrowały, że kopalne taksony niosą istotne dane dla postawienia hipotez o ewolucji (Doyle & Donoghue 1987; Donoghue et al. 1989; O'Leary & Geisler 1999; Gatesy & O'Leary 2001). Metody, ustalone między innymi przez Wilkinsona (1995), skutecznie postępują z fenomenem brakujących danych u skamieniałości (ryc. 1).
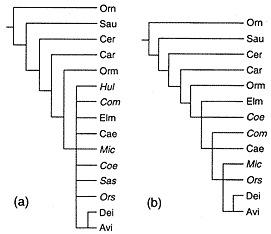 | | Ryc. 1. Kladogramy Saurischia. A. Wynik analizy z wszystkimi taksonami. B. Wynik analizy po działaniu Safe Taxonomic Reduction (Wilkinson 1995). |
Kalibracja zegara molekularnego. - Dane paleontologiczne są niezbędne do kalibracji tak zwanego zegara molekularnego, który wymaga identyfikacji określonych punktów dywergencji linii w zapisie kopalnym.
Teorie specjacji. - Obserwacji zapisu kopalnego można użyć do sprawdzenia teorii specjacji i ewolucji. Przykładem jest morski plankton. W jego zapisie kopalnym widać formy przejściowe, ancestralne i bardziej nowoczesne, w następstwie stratygraficznym w pojedynczych lokalizacjach. Znaczy to, że izolacja geograficzna nie jest wytłumaczeniem ich ewolucji, i trzeba znaleźć inną hipotezę niż ścisły związek przemian ze zdarzeniami specjacji (rozumianej jako rozdzielanie dróg ewolucji). Przykładów rekonstrukcji filogenezy w wymiarze czasowym dostarczyły w szczególności Radiolaria (Lazarus 1986) (ryc. 2).
Procesy wymierania.- Zapis stratygraficzny taksonów może być użyty do zrekonstruowania procesów wymierania. Do tego trzeba użyć danych kladystycznych o tych taksonach (Smith 1994). Poznanie przebiegu wymierań z przeszłości przyczynia się do zrozumienia obecnego spadku liczebności gatunków w niektórych zespołach.
Rekonstrukcja historii bioróżnorodności.- Ilościowo określając rozprzestrzenienie taksonów w zapisie kopalnym paleontolodzy stwierdzili, że zmiany bioróżnorodności podlegaja pewnym prawom (Sepkoski 1996; Benton 2001). Rozumienie przyczyn i sposobów zróżnicowania pomaga w interpretacji podobnych procesów w naszych czasach. Wyliczeń dzisiejszej różnorodności dokonuje się przez liczenie taksonów i osobników oraz używając metod kladystycznych (Faith 1994). Kladogram, używany do oszacowania różnorodności, powinien przedstawiać pokrewieństwa najbliższe prawdziwym. Skamieniałości mają swoją rolę w rekonstrukcji pokrewieństw ich dzisiejszych form.
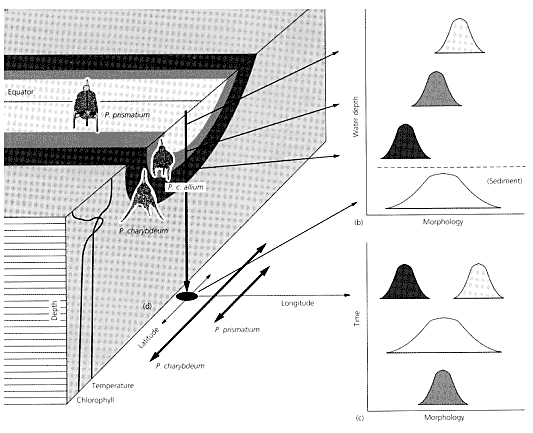 | | Ryc. 2. A. Ewolucja w jednej z linii rozwojowych Radiolaria. B. Związek morfologii z batymetrią sugeruje ewolucyjne przystosowanie do bytowania na różnych głębokosciach. C. Po wprowadzeniu wymiaru czasowego widać ewolucyjną dywergencję i specjalizację form pierwotnie średniej głębokości do warunków płytkich i głębokich wód (C) (wg Lazarus in Briggs & Crowther 2001). |
Ewolucja formy. - Dobre rozumienie ewolucji formy jest istotne, żeby rozumieć homoplazję i homologię, a więc do rozumienia ewolucji jako takiej. Ostatnio widoczne jest duże zainteresowanie genami rozwojowymi (tak zwane geny hox i inne) i ich rolą w ewolucji formy. Skamieniałości są ważne do interpretacji teorii ewolucji struktur (ryc. 3).
Rekonstrukcja historii klimatu i środowiska
Warunki ekologiczne pewnych obszarów w prehistorycznych czasach można zrekonstruować stosując wiedzę o biologii taksonów kopalnych. Analizy tafonomiczne i badania chemiczne skamieniałości dostarczają danych do rekonstrukcji zmian temperatury i klimatu. Rekonstrukcja zmian temperatury i klimatu może nam powiedzieć, czy ostatnie wzrosty temperatury zawierają się w granicach normy. Jeżeli nie, to znaczy gdy ostatnie wzrosty temperatury są wyższe niż oczekiwania oparte na znajomości tych badań, jest to dowód globalnego ocieplenia spowodowanego przez człowieka. Takie były wnioski badań Pearson & Palmer (2001) i Pearson et al. (2001).
Podsumowanie
Główne zastosowania paleontologii są te, które przyczyniają się do rozumienia i rekonstrukcji ewolucji oraz rekonstrukcji historii bioróżnorodności. Badania paleontologiczne dotyczą tematu globalnego ocieplenia i mogą służyć badaniom w biologii molekularnej. Paleontologia jest sama w sobie nauką, dynamiczną, wykorzystującą najnowsze metody geologii, komputerowe i chemiczne. Niektórzy znani paleontolodzy są pionierami rozwoju kladystyki. Więcej informacji na temat zastosowań paleontologii w różnych dziedzinach biologii można znaleźć w książkach Briggsa & Crowthera (1990, 2001).
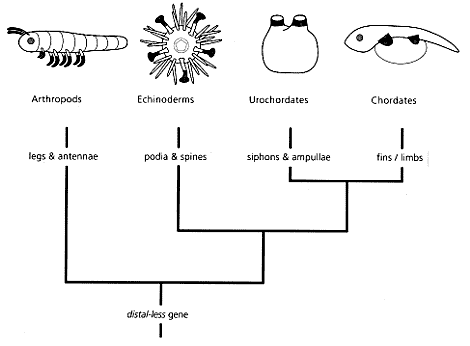 | | Ryc. 3. Gen 'distal-less' jest podobnie wyrażany w strukturach anatomicznych zaczernionych na diagramach (Wray in Briggs & Crowther 2001). Dzięki wiedzy o współczesnych i kopalnych taksonach wiadomo, że części te nie są homologiczne. Działanie genu distal-less nie zostało jeszcze poznane. Dane paleontologiczne dowodzą, że kończyny Tetrapoda są homologiczne płetwom ryb, a nie utworowi gębowemu osłonic Urochordata. |
Literatura
Benton, M.J. 2001. Biodiversity through time. In: D.E.G. Briggs & P.R. Crowther (eds.), Palaebiology II, 211-220. Blackwell Science, Oxford.
Briggs, D.E.G. & Crowther, P.R. (eds) 1990. Palaeobiology: A Synthesis. xiii + 583 pp. Blackwell Science, Oxford.
Briggs, D.E.G. & Crowther, P.R. (eds) 2001. Palaeobiology II. xvii + 583 pp. Blackwell Science, Oxford
Donoghue, M.J., Doyle, J.A., Gauthier, J., Kluge, A.G., & Rowe, T. 1989. The importance of fossils in phylogeny reconstruction. Annual Reviews of Ecology and Systematics 20, 431-460.
Doyle, J.A. & Donoghue, M.J. 1987. The importance of fossils in elucidating seed plant phylogeny and macroevolution. Review of Palaeobotany and Palynology 50, 63-95.
Faith, D.P. 1994. Phylogenetic pattern and the quantification of organismal biodiversity. In: D.L. Hawksworth (ed.), Biodiversity: measurement and estimation. Philosophical Transactions of the Royal Society of London, Series B, Biological Sciences 345, 45-58.
Gatesy, J.G. & O'Leary, M.A. 2001. Deciphering whale origins with molecules and fossils. Trends in Ecology and Evolution 16 (19), 562-570.
Lazarus, D.B. 1986. Tempo and mode of morphologic evolution near the origin of the radiolarian lineage Pterocranium prismatium. Paleobiology 132, 175-189.
O'Leary, M.A. & Geisler, J.H. 1999. The position of Cetacea within Mammalia: Phylogenetic analysis of morphological data from exticnt and extant taxa. Systematic Biology 48 (3), 455-490.
Pearson, P.N., Ditchfield, P.W., Singano, J., Harcourt-Brown, K.G., Nicholas, C.J., Olsson, R.K., Shackleton, N.J., & Hall, M.A. 2001. Warm tropical sea surface temperatures in the Late Cretaceous and Eocene epochs. Nature 413, 481-487.
Pearson, P.N. & Palmer, M.R. 2000. Atmospheric carbon dioxide concentrations over the past 60 million years. Nature 406, 695-699.
Sepkoski, J.J. Jr. 1996. Competition in macroevolution: the double wedge revisited. In: D.H. Jablonski, D.H. Erwin, & J.H. Lipps (eds.), Evolutionary Paleobiology, 211-255. University of Chicago Press, Chicago.
Smith, A.B. 1994. Systematics and the Fossil Record: Documenting Evolutionary Patterns: viii + 223 pp. Blackwell Science, Oxford.
Wilkinson, M. 1995. Coping with abundant missing entries in phylogenetic inference using parsimony. Systematic Biology. 44 (4), 501-514.
Metoda największej wiarygodności - ucieczka ze strefy Felsensteina
KSZYSZTOF SPALIK
Uniwersytet Warszawski
Strefa Felsensteina, czyli kiedy parsymonia może zawodzić
Kiedy triumf metod kladystycznych w taksonomii i filogenetyce wydawał się niewątpliwy, pojawił się niemiły zgrzyt. Jego autorem był Joe Felsenstein (1978), który zadał fundamentalne pytanie o spójność metody opartej na parsymonii. Metoda filogenetyczna jest uważana za spójną wtedy, kiedy wraz z napływem nowych danych otrzymujemy drzewa coraz bliższe prawdziwej filogenezie. Felsenstein wykazał, że w pewnych warunkach metody kladystyczne są niespójne. Co gorsza, są pozytywnie mylące: im więcej danych zbieramy, tym silniej wsparte jest określone drzewo filogenetyczne, ale jest to drzewo błędne!
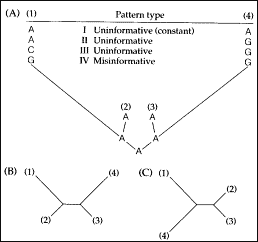 |
Ryc. 1. Przykładowa filogeneza czterech gatunków (A; przedstawione są różne możliwości zmian w liniach 1 i 4) i jej dwie rekonstrukcje (prawdziwa B i fałszywa C). Rekonstrukcje są drzewami niezakorzenionymi (Swofford i in. 1996). |
Rozważmy przypadek drzewa czterech taksonów (ryc. 1 A). Na drzewie tym zaznaczono długości gałęzi, które odzwierciedlają liczbę podstawień w sekwencji, a także - przykładowo - zmiany jednego nukleotydu. U wspólnego przodka była to adenina. Po rozdzieleniu jego linii na dwie potomne bardzo szybko nastąpiły kolejne dywergencje. Na pierwszych gałęziach nie zaszły żadne zmiany i w rozważanej pozycji u obu potomków pozostała adenina. U dalszych potomków wystąpiło silne zróżnicowanie tempa podstawień nukleotydów. Dwie gałęzie są bardzo krótkie - nie zaszły tam prawie żadne zmiany - natomiast dwie są długie, tzn. sekwencje DNA tych taksonów są silnie zmienione. Rozpatrzmy, jakie będą możliwe stany analizowanej cechy (czyli pojedynczej pozycji w sekwencji) u tych taksonów i jakie będą tego konsekwencje dla oszacowania filogenezy metodą parsymonii.
1) Nukleotyd w danej pozycji nie zmieni się - pozostanie adenina. Pozycja ta jest zatem stała, czyli nieinformacyjna filogenetycznie.
2) Jeśli nukleotyd ulegnie podstawieniu na jednej gałęzi, to taka pozycja będzie również nieinformacyjna filogenetycznie. Według zasady parsymonii ważna jest bowiem tylko wspólnota posiadania tej samej cechy zaawansowanej ewolucyjnie.
3) Jeśli na obu gałęziach adenina będzie podstawiona przez różne nukleotydy, np. przez cytozynę i guaninę, to także ta pozycja będzie nieinformacyjna.
4) Z punktu widzenia parsymonii informacyjny filogenetycznie będzie jedynie przypadek, w którym adenina zmieni się na guaninę (albo inną zasadę) równocześnie na obu gałęziach. Ale właśnie ten przypadek jest mylący. Wskazuje bowiem na bliskie pokrewieństwo taksonów (1) i (4), czyli na drzewo C. W gałęziach ewolucyjnych 1 i 4 zmian było wiele (są "długie"), takich przypadków przypadkowej zbieżności jest więc w nich z pewnością więcej, niż w "krótkich" gałęziach 2 i 3. Im więcej danych zbierzemy, tym bardziej możemy być utwierdzeni, że to właśnie drzewo C jest prawdziwe, podczas gdy będzie to artefakt - jesteśmy po prostu w tzw. strefie Felsensteina. Tą nazwą określa się zbiór topologii rzeczywistego drzewa filogenetycznego (strefę w przestrzeni możliwych topologii), w którym jego odtworzenie jest bardzo trudne.
Można próbować podważyć te rozważania, wskazując, że założenie o tak dużych różnicach w tempie ewolucji poszczególnych gałęzi jest nierealistyczne. Niestety, Hendy i Penny (1989) wykazali, że nawet w wypadku zegara molekularnego, czyli stosunkowo wyrównanego tempa ewolucji na poziomie molekularnym, taki efekt występuje. Nazwali go long branch attraction, czyli przyciąganiem się długich gałęzi. Efekt ten spotykamy, kiedy w próbie taksonów pewne gałęzie ewolucyjne są lepiej reprezentowane niż inne (próba jest niereprezentatywna). Odpowiedni wybór taksonów nie zawsze jednak zależy od badacza. Na przykład nie uzyskamy bardziej reprezentatywnej próby miłorzębowych, ponieważ miłorząb dwuklapowy jest jedynym współcześnie żyjącym przedstawicielem tej licznej kiedyś grupy.
Na ile powszechnie spotyka się efekt przyciągania się długich gałęzi? Prawdopodobnie dość często. Istnieją uzasadnione obawy, że taką sytuację mamy w wypadku roślin lądowych - do tej pory nie wiemy na przykład, która grupa mszaków jest grupą siostrzaną roślin naczyniowych, różne sekwencje DNA dają bowiem odmienne oszacowania.
Istnieją metody ucieczki ze strefy Felsensteina. Przyjmują one pewne założenia co do ewolucji na poziomie molekularnym i biorą pod uwagę nie tylko obserwowane zmiany nukleotydów, ale także szacują liczbę wielokrotnych podstawień, które są jedną z przyczyn szumu filogenetycznego. Taką metodą jest m.in. maximum likelihood, czyli metoda największej wiarygodności.
Parsymonia nie uwzględnia tempa ewolucji
Zacznijmy od pokazania, jaka jest różnica między parsymonią a metodą największej wiarygodności (ryc. 2). Drzewo A pokazuje filogenezę sekwencji DNA kilku gatunków. Jak w poprzednio analizowanym przykładzie, zaznaczono zmiany nukleotydów w jednym miejscu sekwencji. Aczkolwiek to drzewo jest narysowane ze strzałką czasu, z formalnego punktu widzenia nie jest zakorzenione. Innymi słowy, nie jest rozłamana gałąź zaznaczonej literą ?. Dla tych rozważań nie jest ważne, w której części tej gałęzi - dolnej czy górnej - zaszły zmiany.
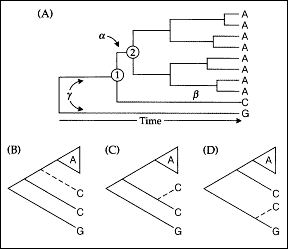 |
Ryc. 2. Przykład ilustrujący różnice w podejściu do rekonstrukcji filogenezy między metodami opartymi na parsymonii a największej wiarygodności (Swofford i in. 1996). Jeśli do zbioru taksonów z ryciny (A) dołączymy obiekt z cytozyną w analizowanej pozycji sekwencji, to według kryterium parsymonii wszystkie drzewa (B)-(D) są równocenne, natomiast funkcja wiarygodności wskazuje na drzewo (C). |
Cyframi 1 i 2 zaznaczono węzły wspólnych przodków dwu grup gatunków. Spróbujmy dociec, jaki nukleotyd występował w rozważanej pozycji u tych przodków. W wypadku przodka 2 sprawa jest oczywista - zgodnie z zasadą parsymonii powinna tam być adenina. Ale co z przodkiem 1? Ponieważ na każdej z trzech gałęzi wychodzących z tego węzła znajduje się inny stan (A, C lub G), wszystkie trzy rekonstrukcje są możliwe. Każda z nich wymaga tylko dwóch podstawień.
Zastanówmy się, gdzie dodana byłaby sekwencja, która ma cytozynę w analizowanej pozycji (ryc. 1, drzewa B, C i D). Pod względem parsymonii równie dobre jest dołączenie tej sekwencji do gałęzi ?, ß, lub ?. Nie wymaga to żadnej dodatkowej zmiany. Podobnie byłoby, gdyby ta sekwencja miała guaninę. Gdzie natomiast najlepiej byłoby dołączyć sekwencję, która miałaby tyminę w tej pozycji? Ją również można dodać do każdej gałęzi tego drzewa, w każdym przypadku bowiem wymaga to jednej dodatkowej zmiany. Podobnie jest z sekwencją, która ma w tej pozycji adeninę - ona także może być dołączona wszędzie. Wpłynie to jednak na rekonstrukcję wspólnego przodka. Jeśli sekwencję z adeniną dołączymy do gałęzi ß lub ?, to musimy założyć, że przodek nr 1 miał także adeninę w tej pozycji. A zatem analizowane miejsce jest informacyjne filogenetycznie jedynie w stosunku do sekwencji z cytozyną i guaniną, natomiast nic nie mówi o przypuszczalnym położeniu sekwencji z tyminą i adeniną.
Zauważmy, że w naszych rozważaniach dotyczących parsymonii ani razu nie pojawił się czas. Metoda parsymonii go zupełnie nie uwzględnia. Ważna jest tylko liczba zmian na całym drzewie.
Metoda największej wiarygodności przyjmuje model podstawiania nukleotydów
Inną perspektywę przyjmuje metoda największej wiarygodności. Stosuje ona odmienne kryterium oceny drzewa. Wybieramy takie drzewo, dla którego prawdopodobieństwo osiągnięcia obserwowanego rozkładu wartości cech na wierzchołkach gałęzi jest najwyższe. Aby oszacować to prawdopodobieństwo, musimy dokonać założeń o przebiegu zmian ewolucyjnych - modelu substytucji nukleotydów w sekwencji. Przyjmijmy model najprostszy:
(1) tempo podstawiania (substytucji) jest jednakowe dla wszystkich par nukleotydów,
(2) wszystkie typy podstawień są jednakowo prawdopodobne,
(3) spodziewana liczba podstawień na dowolnej gałęzi jest funkcją tempa substytucji i długości tej gałęzi (czasu od rozejścia się linii ewolucyjnych).
Te założenia to w zasadzie uproszczony model Jukesa-Cantora. Na razie zakładamy także, iż tempo substytucji jest jednakowe w całym drzewie.
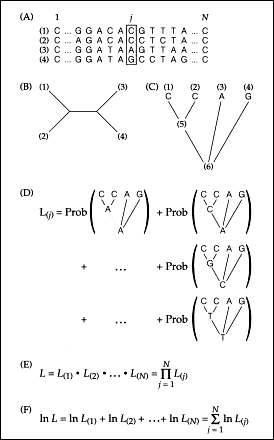 | | Ryc. 3. Obliczanie funkcji wiarygodności (Swofford i in. 1996).
(A) - macierz przyrównanych sekwencji
(B) - jedno z możliwych niezakorzenionych drzew
(C) - drzewo zakorzenione
(D) - suma prawdopodobieństw dla danej pozycji sekwencji
(E) - wartość funkcji wiarygodności to iloraz wartości z wszystkich pozycji sekwencji
(F) - ponieważ jest to bardzo mały ułamek, przedstawia się go w postaci logarytmu naturalnego.
|
Miarą jakości drzewa jest suma prawdopodobieństw zliczona po wszystkich cechach (ryc. 3). Na przykład liczymy prawdopodobieństwo osiągnięcia obserwowanego rozkładu nukleotydów na gałęziach drzewa przy założeniu, że przodek nr 2 miał adeninę, a następnie, że miał tyminę, cytozynę lub guaninę. Sumujemy te prawdopodobieństwa - to jest właśnie funkcja wiarygodności. Należy pamiętać, że funkcja ta nie określa prawdopodobieństwa prawdziwości drzewa, ale jest miarą prawdopodobieństwa osiągnięcia obserwowanego rozkładu stanów cech przy założeniu, że dane drzewo jest prawdziwe.
Zmiany ewolucyjne są rzadkie, a zatem historie ewolucyjne, w których zaszło mniej zmian są bardziej prawdopodobne niż takie, w których tych zmian zaszło więcej. U przodka nr 2 z ryc. 2, bardziej prawdopodobne jest występowanie adeniny niż innego nukleotydu i ono najwięcej wnosi do funkcji wiarygodności. W tym wypadku metoda największej wiarygodności nie odbiega od parsymonii.
Rozważmy teraz węzeł nr 1 (ryc. 2). Wychodzą z niego trzy gałęzie, na każdej z nich występuje inny nukleotyd: A, C i G. Zastanówmy się najpierw, który stan - A czy C - jest bardziej prawdopodobny. Jeśli przodek nr 1 miał adeninę, jak przypuszczamy, to pomiędzy tym węzłem a wierzchołkiem drzewa z cytozyną musiała zajść jakaś zmiana. Ta zmiana mogła zajść albo na gałęzi ?, albo na gałęzi ß. Na której z nich jest bardziej prawdopodobna? Gałąź ? jest stosunkowo krótka, natomiast gałąź ß jest znacznie dłuższa. Długość gałęzi odzwierciedla liczbę podstawień, a zatem jest bardziej prawdopodobne, że rzeczona zmiana zaszła na gałęzi ß niż na gałęzi ?. Pamiętajmy jednak, że wciąż mówimy o prawdopodobieństwie. Metoda największej wiarygodności nie określa, że ta zmiana zaszła na gałęzi ß, ponieważ jest to bardziej prawdopodobne. Jedynie przy liczeniu funkcji wiarygodności dla danego drzewa, taka hipoteza wniesie najwięcej do obliczanej sumy prawdopodobieństw.
W podobny sposób rozważamy, na której gałęzi zaszła zmiana prowadząca do guaniny - na gałęzi ß czy ?. Jest bardziej prawdopodobne, że na gałęzi ?, ponieważ jest ona dłuższa od gałęzi ß. A zatem wartość funkcji daje nam porządek najbardziej prawdopodobnych rozwiązań. Najbardziej prawdopodobny stan u przodka 1 to adenina, potem cytozyna, a na końcu guanina. Jakie to ma znaczenie? Wróćmy do naszego oryginalnego problemu - w którym miejscu będzie dołączona sekwencja z cytozyną w określonej pozycji sekwencji? Przypominam, że w świetle parsymonii drzewa A, B i C są równoprawne. Natomiast w świetle metody największej wiarygodności nie są. Drzewo B wymagałoby rozcięcia gałęzi ? i umiejscowienia zmiany na tej krótkiej gałęzi, co jest mało prawdopodobne. Drzewo D nie wymagałoby rozcięcia tej gałęzi, ale wymagałoby zmiany na niej. Oczywiście możnaby uniknąć podstawienia na gałęzi ?, jeśli założymy dodatkową, niezależną zmianę na tej dołączonej gałęzi. Jest to jednak jeszcze mniej prawdopodobne. A zatem, najbardziej prawdopodobne będzie drzewo C. Zauważmy, że przewaga drzewa C znika, jeśli wydłużamy gałąź ?, np. jeśli przyjmiemy, że tempo ewolucji na tym odcinku jest szybsze.
Podsumowując, metoda największej wiarygodności, w odróżnieniu od metody opartej na parsymonii, uwzględnia długość gałęzi drzewa filogenetycznego. Dlatego też jest spójna. Taki układ bowiem, jaki pojawia się na drzewie w wypadku strefy Felsensteina, jest bardzo prawdopodobny, a zatem będzie wychwycony. Swofford i in. (1996) uważają, że metoda największej wiarygodności jest najlepszą metodą szacowania filogenezy nie tylko z uwagi na spójność. Ma niższą wariancję od innych metod, co znaczy, że jest najmniej wrażliwa na błąd pobierania próby, a także jest bardziej odporna na odstępstwa od założeń o modelu ewolucji.
Wybór właściwego modelu, czyli diabeł tkwi w szczegółach
Pominęliśmy jak dotąd bardzo ważny etap - w jaki sposób oblicza się cząst-kowe prawdopodobieństwa składające się na wartość funkcji wiarygodności dla określonego drzewa. Aby to obliczyć, musimy przyjąć pewne założenia o substytucji nukleotydów, czyli model ewolucji (neutralnej) na poziomie molekularnym. Szczegółowa prezentacja poszczególnych modeli wykracza poza ramy tego omówienia. Warto jednak wiedzieć, że podstawą każdego modelu jest macierz tempa substytucji. Najbardziej ogólną postać tej macierzy przedstawia ryc. 4. Tempo substytucji jednego nukleotydu przez drugi zależy od średniego tempa substytucji ľ, stałej dla każdego typu podstawienia oraz częstości podstawianego nukleotydu. Ponieważ nukleotydów jest cztery, w najbardziej ogólnym modelu substytucji mamy 12 typów podstawień (nie licząc podstawień synonimicznych). Zwykle jednak zakłada się pełną odwracalność ewolucji (model GTR - general time reversible). Macierz jest zatem symetryczna wzdłuż przekątnej, a tym samym otrzymujemy sześć typów substytucji. Niemalże wszystkie modele substytucji DNA są specjalnymi przypadkami modelu GTR (ryc. 5). Na przykład jeśli w modelu GTR ograniczymy liczbę typów przekształceń z sześciu do trzech: transwersji (podstawienia puryny przez pirymidynę i odwrotnie) dwóch typów tranzycji (podstawienia jednej puryny przez drugą i jednej pirymidyny przez drugą), to otrzymamy model Tamury i Nei. Jeśli będziemy rozpatrywać tylko tranzycje i transwersje, to otrzymamy model Hasegawa-Kishino-Yano z 1985 r. albo model Felsensteina z 1984 r. Jeśli te modele uprościmy, zakładając tylko jeden rodzaj podstawienia, to otrzymamy model Felsensteina z 1981 r. A jeśli w tym modelu założymy dodatkowo, że częstości występowania wszystkich nukleotydów są równe, to dojdziemy do najprostszego modelu Jukesa-Cantora. Modele substytucji używane są nie tylko w metodzie największej wiarygodności, ale i w metodach odległościowych.
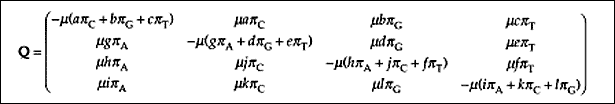 |
Ryc. 4. Macierz tempa substytucji nukleotydów (Swofford i in. 1996). Rzędy i kolumny od lewego górnego rogu dotyczą kolejno adeniny, cytozyny. guaniny i tyminy. Parametry: m - bezpośrednie tempo podstawień; a-l - stałe dla każdego typu podstawienia (razem 12); p - frekwencja danego nukleotydu.
|
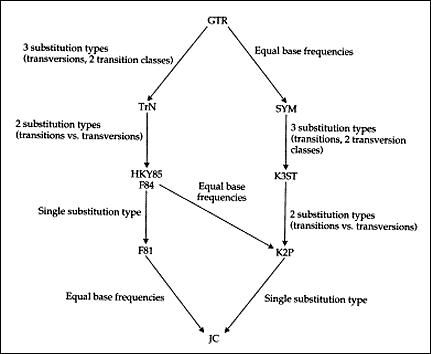 |
Ryc. 5. Zależności między najpowszechniej używanymi modelami substytucji nukleotydów (Swofford i in. 1996). Modele: GTR - general time reversible; TrN - Tamura i Nei; HKY85 - Hasegawa-Kishino-Yano 1985; F84 - Felsenstein 1984; SYM - model Zharkikha 1994; K3ST - trójparametryczny model Kimury; K2P - dwuparametryczny model Kimury; JC - Jukes-Cantor.
|
Macierz substytucji, którą przedstawiliśmy, służy do obliczenia macierzy prawdopodobieństwa zmian jednego nukleotydu w drugi. Ta właśnie macierz jest podstawą wyliczania funkcji wiarygodności.
 |
Ryc. 6. Zmiany kształtu rozkładu ? w zależności od wartości parametru ? (Swofford i in. 1996). |
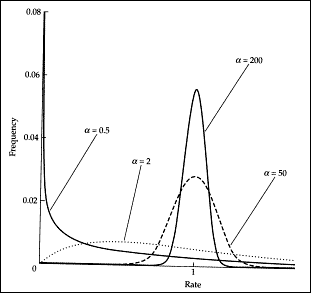
W rozważanym dotychczas modelu założyliśmy, że ewoluują wszystkie miejsca w sekwencji oraz że zmieniają się w takim samym tempie. Założenie takie jest oczywiście błędne. Jeśli to założenie nie jest spełnione, metoda największej wiarygodności jest niespójna, czyli ma taką samą wadę, jak metoda parsymonii. Kiedy bowiem część miejsc pozostaje niezmiennych, to funkcja wiarygodności niedoszacowuje liczbę wielokrotnych podstawień. Tym samym źle wyliczona jest długość gałęzi i błędna filogeneza zostaje oceniona najwyżej. Aby temu zapobiec, można oszacować, jaka część miejsc w sekwencji jest silnie konserwowana i nie przyjmuje żadnych zmian. Można także określić rozkład tempa ewolucji w sekwencji. Zwykle przyjmuje się, że rozkład ten przybiera postać tzw. rozkładu ?. Rozkład ? jest charakteryzowany przez współczynnik kształtu, określany zwykle literą ?. Na ryc. 6 przedstawiono rozkład częstości tempa podstawiania dla różnych wartości parametru ?. Kiedy ? jest niskie, np. 0,5, zauważymy, że najwięcej jest miejsc, które ewoluują wolno, tzn. tempo ich podstawień (na osi x) jest bliskie zeru. Są jednak także nieliczne miejsca, które ewoluują szybko. Im wyższa wartość ?, tym bardziej ujednolica się tempo ewolucji. Na przykład dla wartości tego współczynnika równej 200, wszystkie pozycje są podstawiane w tempie zbliżonym do 1.
Wybór możliwości jest zatem bardzo duży - kilka podstawowych typów modeli, każdy z możliwością oszacowania (lub nie) miejsc niezmiennych oraz zróżnicowaniem rozkładu tempa podstawień (z różnym parametrem kształtu rozkładu). Na szacowanie filogenezy wpływają również częstości nukleotydów i tempa poszczególnych typów podstawień. Który model wybrać? Odpowiedź nie jest prosta. Nie należy się kierować samą wartością funkcji wiarygodności. Drzewa uzyskane za pomocą bardziej złożonych modeli, czyli z większą liczbą parametrów, zawsze mają wyższą wartość tej funkcji niż drzewa bazujące na prostszych modelach. Bardziej złożone modele (z większą liczbą stopni swobody) są jednak wrażliwsze na błąd próby. Innym ograniczeniem jest czas obliczeń. Metoda największej wiarygodności jest najbardziej złożoną obliczeniowo metodą szacowania filogenezy. A im więcej parametrów, tym więcej obliczeń do wykonania.
Podobnie jak w wypadku innych modeli, można stosować do ich porównania test wiarygodności albo np. kryterium informacyjne Akaike'go. Trzeba zaznaczyć, że są to środki pomocnicze - badanie ewolucji nie poddaje się w pełni statystyce, dotyczy bowiem odtwarzania przeszłości.
Literatura
Felsenstein, J. 1978. Cases in which parsimony and compatibility methods will be positively misleading. Systematic Zoology 27, 401-410.
Hendy, M.D. & Penny, D. 1989. A framework for the quantitative study of evolutionary trees. Systematic Zoology 38, 297-309.
Swofford, D.L., Olsen, G.J., Waddell, P.J., & Hillis, D.M. 1996. Phylogenetic inference. In D. M. Hillis, C. Moritz, B.K. Mable (ed.), Molecular systematics. 2nd ed. 407-514. Sinauer Associates, Sunderland.
Filozofia rekonstrukcji historii organizmów
ANDRZEJ ELŻANOWSKI
Uniwersytet Wrocławski
Przedmiotem tej prezentacji jest najpierw określenia poznawczego statusu rekonstrukcji genealogii organizmów czyli rekonstrukcji filogenetycznych (RF) czyli ich miejsca w ogólnym schemacie biologii ewolucyjnej, a następnie zastosowanie RF do rekonstrukcji historii organizmów wraz z ich biologicznymi atrybutami, co z kolei jest warunkiem przyczynowego wyjaśniania przebiegu ewolucji. Problematyka ta jest nowa i metodologia rekonstrukcji historii organizmów rozpracowana jest w małym stopniu w porównaniu z metodologią RF.
Ostatnie dekady przyniosły bezprecedensowy wpływ filozofii (metodologii) nauki na dyscyplinę myślenia w naukach przyrodniczych, szczególnie dążenie do sprawdzalności hipotez i ograniczenie spekulacji. Filozofia nauki (szczególnie Karl Popper i jego falsyfikacjonizm) wyrosła na gruncie neopozytywizmu, rozwinęła się jako filozofia fizyki i konsekwentnie stworzyła hipotetyczno-dedukcyjny (nomologiczno-dedukcyjny) schemat wyjaśniania, w którym zdanie opisujące stan wyjaśniany, czyli eksplanandum wynika logicznie z eksplanansu będącego koniunkcją zdań formułujących prawa L1, L2, L3... i warunki początkowe: C1, C2, C3.... Wyjaśnianie takie określane jest jako syntaktyczne ponieważ zdanie eksplanandum wynika tu logicznie z koniunkcji zdań eksplanansu. Taki schemat wyjaśniania nie działa w biologii ewolucyjnej.
Wyjaśnianie w biologii polega na modelowaniu (interpretacji) wyjaśnianego obiektu czyli tworzenie konstruktów izomorficznych z tym obiektem (tzn. takich, których struktura logiczna odpowiada jego strukturze materialnej). Dlatego wyjaśnianie w biologii określane jest jako semantyczne (Thompson 1989; Lloyd 1994), w nawiązaniu do nadawania znaczenia obiektowi przez jego interpretację (modelowanie). W biologii ewolucyjnej (historycznej) model wyjaśnia każde stadium organizmalne jako wynik przekształcenia poprzedniego stadium. Takie wyjaśnianie nazywa się wyjaśnianiem historycznym i wymaga przynajmniej częściowej rekonstrukcji stadium poprzedzającego.
Poznawczy status rekonstrukcji filogenetycznych (RF)
Pomijając ich rolę jako podstawy klasyfikacji, RF są prostymi, częściowymi modelami ewolucji, które pozwalają na częściową rekonstrukcję stadiów poprzedzających poprzez filogenetyczne mapowanie i optymalizację cech. Filogenetyczne mapowanie polega po prostu na nanoszeniu cech, np. heterochronii, na RF, dzięki czemu nieuporządkowane różnice mogą być odczytane jako zmiany (które następnie mogą być wyjaśniane przyczynowo). Ponadto naniesione cechy mogą być optymalizowane.
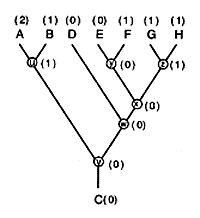
Optymalizacja cech. - Optymalizacja cech (character optimization, Kitching et al. 1998) polega na znalezieniu najbardziej oszczędnego (most parsimonious) schematu zmian tych cech dla danej RF. OC jest zabiegiem logicznie odwrotnym w stosunku do tworzenia RF, które polega na znalezieniu najprawdopodobniejszej genealogii przy danych cechach każdego z taksonów. OC polega na przyporządkowywaniu stanów cech na węzłach kladogramu, postępując najpierw od końcowych gałęzi do korzenia kladogramu, a potem, w niektórych sposobach OC, jeszcze na odwrót, od korzenia do gałęzi. Różne sposoby OC oparte są na różnych założeniach o ewolucji cech, np. optymalizcja Camina-Sokala (Camin-Sokal optimization) zakłada nieodwarcalność zmian (ryc. 1).
 | Ryc. 1. Optymalizacja cech (OC) na przykładzie optymalizacji Camin'a-Sokal'a, która zakłada nieodwracalność zmian, a więc jeżeli pochodne stany cech są różne, to węzłowi (u, y, x) przypisuje się niższą wartość (wg. Kitching i in. 1998). Ten sposób OC nadaje się na przykład do odtworzenia filogenezy opieki rodzicielskiej. |
Dzięki mapowaniu i optymalizacji, RF mają podwójną rolę poznawczą. Po pierwsze, RF wyjaśniają pewne podobieństwa organizmów jako podobieństwa odziedziczone po przodkach czyli podobieństwa homologiczne. Po drugie RF jest podstawowym, pierwszym krokiem do całościowej rekonstrukcji historii organizmów, w tym rekonstrukcji ich funkcjonowania.
Rekonstrukcja funkcji i innych niezachowanych atrybutów
Rekonstrukcja funkcji jest szczególnym przypadkiem rekonstrukcji niezachowanych atrybutów organizmów kopalnych. Niektóre atrybuty, np. formy zachowania i miękkie organy, na ogół nie pozostawiają śladów w materiale kopalnym i dlatego mogą być przyporządkowane organizmowi wymarłemu tylko metodą filogenetyczną. Inne są ściśle skorelowane z obecnością czy budową części twardej. Np. wyrostek dziobiasty (proc. coronoideus) żuchwy ssaków służy do przyczepu i rozwija się pod wpływem m. skroniowego (m. temporalis), dlatego obecność tego wyrostka świadczy z prawdopodobieństwem bliskim pewności o obecności tego mięśnia. W takich prostych wypadkach samo ustalenie homologii części szkieletowej wystarczy do wnioskowania o obecności homologicznej części miękkiej, ale w innych wypadkach korelacja nie jest tak silna i wtedy podparcie wnioskowania kladogramem jest istotne.
Są dwa podstawowe podejścia do rekonstrukcji funkcji kopalnych organizmów, paradygmatyczne i filogenetyczne (Bryant & Russell 1992; Lauder 1995; Weishampel 1995; Wu & Russell 1997). Metoda paradygmatyczna (Rudwick 1964; Raup & Stanley 1978), znana też jako ahistoryczna, polega na określeniu własności struktur nadających się do pełnienia pewnej funkcji, a następnie porównaniu takich modeli z badaną częścią kopalnego organizmu, co pozwala zidentyfikować funkcjonalny paradygmat dla badanej struktury kopalnej. Paradygmat może być określony na drodze modelowania metodami fizykalno-inżynierskimi oraz/lub poszukiwania żyjących analogów. Paradygmatyczna rekonstrukcja funkcji jest trudnym zadaniem, ponieważ sposób działania struktury zależy nie tylko od niej samej, ale też od jej kontroli nerwowej (Lauder 1995) oraz nawet u dzisiejszych organizmów szczegółowe poznanie i zrozumienie funkcjonowania wielu organów, jak np. kończyny ze wszystkimi jej mięśniami, wymaga złożonej neontologicznej rekonstrukcji na podstawie ich struktury i danych eksperymentalnych (np. elektromiografii). Tym trudniejsza i z pewnością nie w pełni wykonalna jest szczegółowa rekonstrukcja funkcjonowania kopalnego zwierzęcia, np. kończyny kopalnego czworonoga, który nie ma podobnych, blisko spokrewnionych form w dzisiejszej faunie. Wobec inherentnych trudności w deterministycznym określeniu funkcji na podstawie samej struktury, niezależne probabilistyczne potwierdzenie metodą filogenetyczną nabiera szczególnego znaczenia.
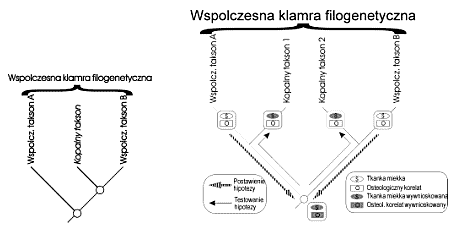 | | Ryc. 2. Współczesna klamra filogenetyczna (extant phylogenetic bracket) zamykająca kopalny takson między bliższą (siostrzaną) outgrupę B i dalszą outgrupę A oraz jej zastosowanie do rekonstrukcji niezachowanej części miękkiej związanej z elementem szkieletu (uproszczone z Witmer'a 1995). Ten sam alogorytm można zastosować do rekonstrukcji funkcji przy zachowanym korelacie strukturalnym. Jeżeli klamra zawiera więcej niż jeden takson kopalny, to występowanie korelatu w każdym z nich uprawdopodobnia jego występowanie u wspólnego przodka. |
Metoda filogenetyczna, zwana też historyczną, sprowadza się do zastosowania optymalizacji cech (OC) wprowadzonych do RF przez taksony dzisiejsze. Polega na wykorzystaniu potwierdzonego kladogramu do probabilistycznego (ale czasem z prawdopodobieństwem bliskim pewności) przypisania organizmom kopalnym atrybutów pokrewnych organizmów dzisiejszych. Najprostszym przypadkiem optymalizacji rozkładu cech do przypisania niezachowanych atrybutów organizmom kopalnych jest zastosowanie współczesnej klamry filogenetycznej (extant phylogenetic bracket) (Witmer 1995), która polega na tym (Ryc. 1), że dla organizmu kopalnego znajduje się najbliższą outgrupę (współczesną grupę siostrzaną) i dla takiej dychotomii znajduje się dalszą współczesną outgrupę. Jeżeli stany badanej cechy są zgodne w obu outgrupach, to prawdopodbnie taki był stan ich wspólnego przodka i wszystkich jego potomków, w tym badanego organizmu kopalnego. Na tej podstawie jest np. prawdopodobne, że wspólni triasowi przodkowie krokodyli i ptaków posiadali żołądek mięśniowy (co zostało częściowo potwierdzone znaleziskami gastrolitów dinozaurów) oraz wiele wspólnych cech rozrodu, w tym budowę ciałka żółtego i jajowodów, zmineralizowane kalcytem (a nie aragonitem jak u żółwi) skorupki jajowe oraz opiekowali się zarówno lęgiem jak i młodymi po wylęgu.
Jeżeli jednak stany cechy w każdej z outgrup są różne, to wnioskowanie o stanie tej cechy u formy kopalnej jest ambiwalentne. Ambiwalencja taka może zostać rozstrzygnięta na drodze optymalizacji cech tylko wtedy, jeżeli dostępna jest jeszcze dalsza, trzecia outgrupa (ryc. 2), która określa stan cechy w korzeniu kladogramu i umożliwia zastosowanie każdego ze sposobów OC.
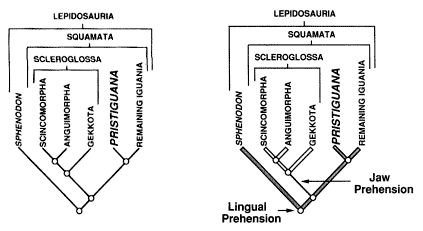 | | Ryc. 3. Rekonstrukcja filogenezy głównych grup lepidozaurów (po lewej) i oparta na niej optymalizacja dwóch cech: chwytania pokarmu językiem (lingual prehension) i szczękami (jaw prehension) (wg Weishampel 1995). Współczesna klamra Iguania-Scleroglossa nie rozstrzyga sposobu pobierania pokarmu przez najstarszą gałąz Iguania (reprezentowaną tutaj przez Pristiguana z gónej kredy Brazylii). Dopiero dzięki dodaniu tuatary (Sphenodon) jako trzeciej outgrupy chwytanie szczękami okazuje się być najprawdopodobniej apomorfią Scleroglossa, a chwytanie językiem symplezjomorfią Sphenodon i Iguania, która najprawdopodobniej zachowała się również u Pristiguana. |
Metoda filogenetyczna oczywiście nie może być stosowana do wnioskowania o funkcji takich struktur kopalnych, które nie występują u współczesnych outgrup. Dla takich przypadków stosowna jest tylko rekonstrukcja paradygmatyczna. Na przykład oczywiste jest, że 2. palec stopy teropodów opatrzony sierpowatym pazurem funkcjonował inaczej niż homologiczne palce krokodyli i ptaków.
Metoda filogenetyczna jest probabilistycznym sposobem przypisywania organizmom kopalnym cech dzisiejszych organizmów i jako taka opiera się na założeniu skrajnego aktualizmu, które na pewno nie zawsze jest całkiem prawdziwe. Metoda ta była też skrytykowana jako sposób na kreowanie abstrakcyjnego "everyanimal" o uśrednionych cechach współczesnych taksonów. Na szczęście wnioski z zastosowania tej metody są weryfikowalne albo metodą paradygmatyczną albo bezpośrednio przez zapis kopalny, który przy fachowym odczycie dostarcza informacji nawet na temat zachowań kopalnych zwierząt (takich jak opieka rodzicielska) albo fizjologii ich organów miękkich (np. jajowodu na podstawie budowy skorupki jajowej i struktury zniesienia).
Literatura
Bryant, H.N. & Russell, A.P. 1992. The role of phylogenetic analysis in the inference of unpreserved attributes of extinct taxa. Philosophical Transactions of the Royal Society of London B, 337, 405-418.
Kitching, I.J., Forey, P.L. Humphries, C. J., & Williams D. M. 1998. Cladistics. 2. wyd. 228 pp. Oxford Universiy Press.
Lauder, G.V. 1995. On the inference of function from structure. In: J. Thomason (ed.) Functional Morphology in Vertebrate Paleontology, 1-18. Cambridge University Press.
Lloyd, E.A. 1994. The Structure and Confirmation of Evolutionary Theory. Princeton University Press, Princeton.
Raup, D.M. & Stanley, S.M. 1978 (1984). Podstawy Paleontologii. 526 pp. PWN, Warszawa.
Rudwick, M.J.S. 1964. The inference of function from structure in fossils. British Journal for the Philosophy of Science 15, 27-40.
Thompson P. 1989. The Structure of Biological Theories. 000 pp. State University of New York Press, Albany.
Weishampel, D.B. 1995. Fossils, function, and phylogeny. In: J. Thomason (ed.) Functional Morphology in Vertebrate Paleontology, 34-54. Cambridge University Press.
Witmer, L.M. 1995. The Extant Phylogenetic Bracket and the Importance of Reconstructing Soft Tissues in Fossils. In: J. Thomason (ed.) Functional Morphology in Vertebrate Paleontology, 19-33. Cambridge University Press.
Wu, X.-C. & Russell, A.P. Functional Morphology. In: P.J. Currie & K. Padian (eds) Encyclopedia of Dinosaurs, 258-268. Academic Press.
Ciągły zapis ewolucji wczesnokredowego ślimaka
ANDRZEJ KAIM
Instytut Paleobiologii PAN
Podstawową trudnością w odtwarzaniu ciągłych zmian ewolucyjnych jest znalezienie profilu geologicznego zawierającego skały tworzące się w odpowiednio długim okresie czasu bez znaczących luk sedymentacyjnych. Skamieniałości powinny być liczne i dobrze zachowane.
Warunki takie oferuje odłonięcie iłów walanżyńskich w wyrobisku cegielni w Wąwale koło Tomaszowa Mazowieckiego. Odsłania się tam profil czarnych iłów dolnego i części górnego walanżynu, co odpowiada interwałowi czasowemu około pięciu milionów lat. W skałach tych zapisał się cykl transgresja-regresja podkreślony pojawieniem się w czasie najwyższego stanu wód faun amonitowych z Oceanu Tetydy. Czarne iły w Wąwale zawierają bardzo liczną i zróżnicowaną faunę szkieletową zarówno kalcytową jak i aragonitową. Wśród tysięcy innych skamieniałości bardzo liczne są muszle ślimaków (patrz Kaim 2001). Wśród około pięćdziesięciu gatunków jeden wykazuje zmiany, prawdopodobnie natury ewolucyjnej.
Rissoina (Buvignieria) sp. należąca do rodziny Rissoidae była przodoskrzelnym, morskim ślimakiem z dwufazowym rozwojem larwalnym (jajo veliger dorosły ślimak) odzwierciedlonym w budowie muszli (skręt embrionalny protokoncha teleokoncha).
Z omawianego profilu pobrałem 37 próbek skały, około 2,5 kg każda. Próbki przemyłem na sicie o oczkach 0,5 mm średnicy. Rissoina sp. odnalazłem w 23 próbkach w łącznej liczbie 174 okazów, co stanowi około 1 % wszystkich muszli ślimaków. Muszle zachowane są zwykle jako protokoncha i jeden do dwóch skrętów teleokonchy. Z tego powodu byłem w stanie zmierzyć parametry morfometryczne jedynie na pierwszym skręcie teleokonchy.
Do pokazania zmian morfologii i wielkości muszli zmierzyłem cztery parametry na każdego osobnika:
1. średnica pierwszego skrętu teleokonchy (D),
2. Wysokość skrętu od szwu do szwu na końcu pierwszego skrętu (WH),
3. Kąt apikalny muszli (A),
4. Kąt załamania skrętu (SA).
Pierwsze dwa parametry (D, WH) opisują zmianę wielkości muszli, natomiast następne dwa (A, SA) opisują zmiany w morfologii muszli.
Ewolucję Rissoina sp. w profilu Wąwału (ryc. 1) można podzielić na dwa etapy.
1. Etap transgresji morza (= niestabilne warunki hydrologiczne): D i WH stopniowo rosną (= zwiększanie wielkości protokonchy), wartości A i SA są stabilne.
2. Etap maksymalnego zasięgu morza (= stabilne warunki hydrologiczne): D i WH prawie stałe, A i SA zmieniają sie stopniowo odzwierciedlając ewolucję od form z muszlą wydłużoną do form z muszlą izometryczną i silnym żebrem spiralnym na zagieciu skrętu.
Wraz z regresją morza Rissoina sp. zanika.
Obserwowany patern ewolucji wskazuje, że morfologia muszli jest praktycznie stała w środowisku niestabilnym, natomiast ewoluuje dość szybko w środowisku stabilnym. Taki zapis ewolucji jest zgodny z koncepcją "Starożytnego Jeziora" (Ancient Lake) wprowadzoną przez Gorthnera & Meier-Brooksa (1985) dla gradualnej ewolucji ślimaków w słodkowodnych jeziorach Ochryd i Prespa. Podobny przebieg ewolucji był również obserwowany w kopalnych jeziorach w Basenie Steinheim, Niemcy (Reif 1985; Gorthner & Meier-Brooks 1985) i na wyspie Kos, Grecja (Willmann 1985) a także u innych zwierząt kopalnych: małżoraczków (Olempska 1989), konodontów (Dzik 1999 i literatura tamże) i trylobitów (Sheldon 1996).
Ewolucja Rissoina sp. jest kolejnym przykładem (patrz Dzik 1999) że niestabilność środowiska nie sprzyja zwiększeniu tempa ewolucji a wręcz przeciwnie, gatunki ewoluują w środowiskach stabilnych.
 |
Ryc. 1. Zapis ewolucji ślimaka Rissoina (Buvignieria) sp. z walanżyńskich osadów wczesnej kredy.
D. średnica muszli; SH. Wysokość skrętu od szwu do szwu na końcu pierwszego skrętu; SA. Kąt załamania skrętu; A. Kąt apikalny muszli.
|
Literatura
Dzik, J. 1999. Relationship between rates of speciation and phyletic evolution: stratophenetic data on pelagic conodont chordates and benthic ostracods. Geobios 32, 205-221.
Gorthner, A. & Meier-Brooks, C. 1985. The Steinheim Basin as a paleo-ancient lake. Lecture Notes in Earth Sciences 1, 322-334.
Kaim, A. 2001. Faunal dynamics of juvenile gastropods and associated organisms across the Valanginian transgression-regression cycle in central Poland. Cretaceous Research 22, 333-351.
Olempska, E. 1989. Gradual evolutionary transformations of ontogeny in a Ordovician ostracod lineage. Lethaia 22, 159-163.
Reif, W.-E. 1985. Endemic evolution of Gyraulus kleini in the Steinheim Basin (planorbid snails, Miocene, Southern Germany). Lecture Notes in Earth Sciences 1, 256-294.
Sheldon, P.R. 1996. Plus ça change - a model for stasis and evolution in different environments. Palaeogeography, Palaeoclimatology, Palaeoecology 127, 209-227.
Willmann, R. 1985. Responses of the Plio-Pleistocene freshwater gastropods of Kos (Greece, Aegean Sea) to environmental changes. Lecture Notes in Earth Sciences 1, 295-321.
Próba odtworzenia ewolucji rauizuchidów w związku z nowymi materiałami Teratosaurus sp. z Krasiejowa
TOMASZ SULEJ
Instytut Paleobiologii PAN
Rauizuchy to drapieżne gady triasowe z grupy archozaurów pokrewne krokodylom. Wyróżnia sie wśród nich czworonożne rauizuchidy i dwunożne popozaury (Long & Murry 1995). Rauizuchy miały kończyny ustawione pionowo pod tułowiem, jak u późniejszych dinozaurów. Konstrukcja stawu biodrowego rauizuchów była jednak znacznie prymitywniejsza niż u dinozaurów. Dinozaury wykształciły bowiem główkę kości udowej skierowaną do wnętrza pionowo ustawionej głębokiej panewki, natomiast u rauizuchów panewka kości biodrowej była ustawiona nad poziomą główką kości udowej (Bonaparte 1984). Prawdopodobnie konstrukcja właściwa dla dinozaurów pozwalała na większą ruchliwość kości udowej. Zmiany w ustawieniu kończyn pociągały za sobą także przemiany stawu skokowego.
Ponieważ pierwotne gady miały kończyny rozstawione na boki, możliwa była duża ruchliwość stopy względem kości podudzia. Dla udoskonalenia chodu u wielu grup nogi stopniowo przemieszczały się pod tułów uzyskując w końcu pozycję pionową. Wpływało to na modyfikacje budowy stawu skokowego. U dwunożnych form, które biegały na kończynach ustawionych pionowo, staw skokowy działał jak poziomy zawias i wykształcił się między kośćmi stępu i śródstopia.
W ewolucji mniej wyspecjalizowanych przodków dzisiejszych krokodyli i rauizuchów wykształcił się staw, w którym kość skokowa ma główkę obracającą się w panewce kości piętowej. Być może zwierzęta te miały kończyny rozstawione na boki, a w biegu podciągały je pod tułów. Boczne ustawienie kończyn wymuszało dużą ruchomość kości stępu względem siebie, jednak ich sprawne działanie w biegu wymagało wzajemnego ścisłego dopasowania. Na podstawie podobieństw w budowie stawu skokowego przodków krokodyli, rauizuchy, aetozaury i fitozaury łączy się w grupę Crurotarsi (Sereno 1991). Rauizuchy odróżnia od aetozaurów i fitozaurów zarówno krótka czaszka dużego lądowego drapieżnika, jak i pionowe ustawienie kończyn pod tułowiem, co wiąże się budową kości biodrowej, wzmocnionej przyporą nad panewką.
Rauizuchidy laurazyjskie
Rauizuchy występowały w triasie na wszystkich kontynentach z wyjątkiem Australii i Antarktydy (Gower & Sennikov 2000). Ich filogeneza jest wciąż słabo poznana co odzwierciedla się w taksonomii. Wiadomo jednak, że rozkwit tej grupy przypadł na późny trias (ryc. 1). Z Europy opisano trzy gatunki: Ticinosuchus ferox Krebs, 1965 z anizyku (Krebs1965), Batrachotomus kupferzellensis Gower, 1999 z ladynu (Gower 1999), oraz Teratosaurus suevicus Meyer, 1861. z noryku. Teratozaur był dotąd znany z Wirtembergii wyłącznie na podstawie kości szczękowej i biodrowej (Meyer 1861; Galton 1985). W 2000 roku w Krasiejowie Michał Ploch i Magdalena Knap znaleźli liczne kości czaszki, kręgi szyjne i ogonowe należące do jednego osobnika. Wśród nich były trójkątne masywne kości przedczołowe i kość łuskowa mająca swoistą, skierowaną do dołu półkę. Ponieważ cechy te są charakterystyczne dla Postosuchus kirkpatricki Chatterjee 1985, rauisuchida znanego z późnego triasu z Ameryki Północnej, okazy z Krasiejowa wstępnie oznaczone jako Postosuchus sp. (Dzik 2001). Dzięki dobrze zachowanym śladom szwów między kośćmi możliwe było zrekonstruowanie całej czaszki. Duże nozdrza ograniczone łukowatą kością nosową, mającą dodatkowy wyrostek skierowany ku dołowi odróżniają ją od postozucha. Ponieważ kość szczękowa jest bardzo podobna do typowego okazu Teratosaurus suevicus, okazy z Krasiejowa zaliczono do tego rodzaju.
Wymienione różnice względem Postosuchus kirkpatricki (Chatterjee 1985) są nieznaczne w porównaniu z innymi rauizuchidami, można więc przypuszczać że formy te były ze sobą blisko spokrewnione, a być może powinny być zaliczone do jednego rodzaju.
Czy istniały dwie linie rozwojowe rauizuchidów
W późnym triasie kontynenty połączone były w jeden superkontynent Pangeę. W związku z tym stopień regionalizacji faun czworonogów był niewielki. Mimo to zaobserwować można pewne różnice pomiędzy rauizuchidami laurazjatyckimi (Postosuchus i Teratosaurus) i gondwańskimi, które mogą sugerować, że stanowią one dwie odrębne gałęzie ewolucyjne. Jedyne gondwańskie gatunki znane z późnego triasu z kompletnych czaszek pochodzą z Ameryki Południowej. Porównanie przedstawione poniżej dotyczyć będzie następujących ich przedstawicieli: Saurosuchus galilei (Reig, 1958), Fasolasuchus tenax (Bonaparte, 1981) i Prestosuchus chiniquensis (Barberena, 1978). Zwierzęta te miały węższe pyski niż formy północne. Ich kość szczękową wyróżnia wydłużona część znajdująca się przed wyrostkiem dorsalnym, który był u nich węższy i niższy niż u postozucha i teratozaura. U Fasolasuchus widać także połączenie kości szczękowej z przedszczękową. Pierwsza z nich tworzy pionową półkę, do której przylegał długi wyrostek kości przedszczękowej. Było to, więc stosunkowo stabilne połączenie. Dodatkowo wzmacniało je poziome położenie tego wyrostka. Podobną budowę wykazują także pozostałe formy. U teratozaura i postozucha powierzchnie styku omawianych kości są gładkie, co może świadczyć o istnieniu ruchomości między nimi (Chatterjee 1985).
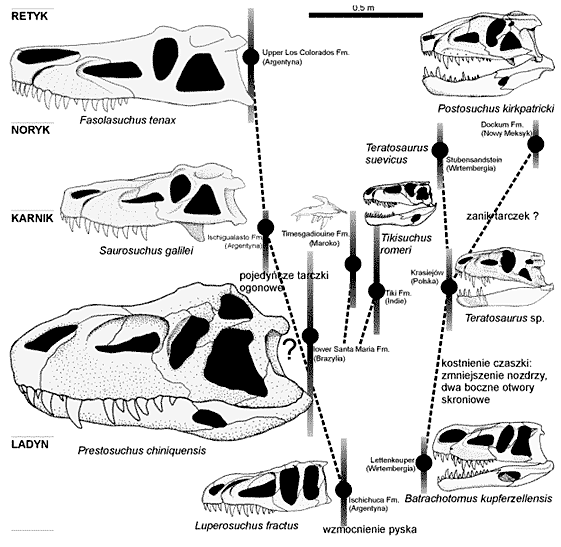 |
Ryc. 1. Rozprzestrzenienie stratygraficzne i geograficzne późnych rauizuchów. |
Wyrostek kości przedszczękowej u teratozaura i postozucha jest znacznie krótszy i ustawiony bardziej ukośnie. Choć osłabia to konstrukcję czaszki, sprzyja jej wewnętrznej ruchomości. Także stawowe połączenie kości kwadratowej z łuskową oraz brak szwów w symfyzie żuchwy widoczne u teratozaura wskazuje na istnienie kinetyzmu czaszkowego. Można przypuszczać, że szczęki postozucha i teratozaura tworzyły dwie płyty, mogące odchylać się na boki, podwieszone pod mocny dach czaszki
Omawiane gałęzie różnią się także budową dachu czaszki. Gatunki z Ameryki Południowej mają wąski, delikatnie wyodrębniony dach czaszki z wcięciem nad oczodołami widocznym w widoku z góry. Natomiast teratozaur i postozuch miały szeroki dach czaszki obrzeżony zgrubiałą krawędzią z masywną kością przedczołową nad oczodołami.
Czaszki tych zwierząt są mniej ażurowe w porównaniu do gatunków z Ameryki Południowej Zamiast jednego dużego dolnego otworu skroniowego mają dwa mniejsze otwory, także nozdrza są mniejsze, a kości nosowe bardziej masywne. Wszystkie te różnice prawdopodobnie związane były z adaptacjami do różnego typu pokarmu.
Przystosowania do różnych sposobów polowania
Wyminione wyżej różnice między rauizuchidami z Ameryki Południowej i półkuli północnej sugerują, że polowały one na różne ofiary. Chatterjee & Majumdar (1987) jako potencjalne ofiary rauizuchidów zaproponowali opancerzone aetozaury, roślinożerne rynchozaury oraz duże roślinożerne gady ssakokształtne - dicynodonty. Dicynodonty są znane od późnego permu, rynchozaury od wczesnego triasu, obie grupy występują do końca karniku. Miały ogólnoświatowe rozprzestrzenienie, bardzo wiele form opisano z Ameryki Południowej. Łączy je brak pancerza oraz masywna budowa ciała.
Aetozaury zaś znane są od późnego karniku aż do końca triasu. Choć także były szeroko rozprzestrzenione to zdecydowanie dominują w Ameryce Północnej i Europie, gdzie w późnym karniku rynchozaury i dicynodonty są znajdowane rzadko.
Przedstawiony podział potencjalnych ofiar rauizuchów koreluje się ze stratygraficznym i przestrzennym występowaniem omówionych wcześniej dwóch grup rauizuchidów. Formy o wąskich pyskach i ażurowych czaszkach znane są z Ameryki Południowej od ladynu do retyku. Najstarszym przedstawicielem tej grupy jest Luperosuchus fractus z formacji Ischichuca (Romer 1971). Natomiast teratozaur i postozuch znane są odpowiednio z karniku Europy i noryku Ameryki Północnej. Choć Long & Murry (1995) określili najstarsze występowanie postozucha na późny karnik to zaznaczyli, że jest ono wątpliwe. Holotyp i większość materiału pochodzi z noryku. Można, więc przypuszczać, że postozuch jest młodszy niż teratozaur z Krasiejowa i mamy do czynienia z laurazjatycką linią ewolucyjną. Niedawno opisany Batrachotomus kupferzellensis z ladynu Wirtembergii miał jeszcze stosunkowo ażurową czaszkę. Łączy go z teratozaurem i postozuchem duża kość przedczołowa i szeroki pysk. Ponieważ jest geologicznie starszy od teratozaura i występuje w tym samym regionie Basenu Germańskiego można przypuszczać, że jest jego przodkiem. W ewolucji następowało zapewne stopniowe zmniejszanie nozdrzy oraz kostnienie boków czaszki, co doprowadziło do dwóch dolnych otworów skroniowych u teratozaura a następnie zmniejszenia górnego u postozucha. Następowało też poszerzenie dachu czaszki, głównie w wyniku powiększenia prefrontale.
Można przypuszczać, że wykształcenie w tej grupie mocnego dachu czaszki, pod którym były zawieszone wzmocnione płyty boczne z masywnymi szczękami, a także ruchomych ramion żuchwy, nastąpiło w środkowym lub późnym karniku wraz z pojawieniem się aetozaurów i było przystosowaniem do polowania na te opancerzone zwierzęta. Ruchomość czaszki powodowała, że w trakcie uderzenia zębami w ochronne tarcze kostne zęby ześlizgiwały się z tarczek trafiając na ich połączenia i wbijały się w miękkie tkanki. Można przypuszczać, że na zęby umieszczone w stabilnej czaszce działałyby w takiej sytuacji duże siły boczne powodujace ich wyłamywanie.
Mniejsze przemiany można zaobserwować w linii znanej z Ameryki Południowej. Rauizuchy te polowały na nieopancerzone masywne zwierzęta. Ich wąskie pyski lepiej były dostosowane do cięcia niż wewnętrznie ruchoma czaszka postozucha. Być może wzrost tych rauizuchidów widoczny od ladynu do retyku był odpowiedzią na zwiększanie rozmiarów przez rynchozaury lub dicynodonty (występownie takiego trendu nie jest pewne). Prawdopodobnie po wymarciu rynchozaurów i dicynodontów rauizuchidy z Ameryki Południowej konkurowały o roślinożerne prozauropody z pierwszymi dinozaurami takimi jak Herrerasaurus (Bonaparte 1984).
Hipotezę o zróżnicowaniu nisz zajmowanych przez rauizuchy potwierdzają także rozmiary zwierząt. Postozuch mógł bowiem osiągać 5 metrów długości, zaś większość aetozaurów nie przekraczała 3 metrów, choć znane są też formy osiągające 6 metrów. Z kolei drapieżniki południowo-amerykańskie osiągały ponad 7 metrów długości, polowały bowiem na bardzo masywne, w porównaniu do aetozaurów, dicynodonty osiągające 4,5 metra długości.
Czy istniała osobna gondwańska linia rauizuchów?
Późnotriasowe rauizuchidy są znane także z północnej Afryki, z formacji Timesgadiouine (Dutuit 1979) gdzie współwystępują z dicynodontami, oraz z Indii - Tikisuchus romeri (Chatterjee & Majumdar 1987). Z obu stanowisk opisane zostały także aetozaury. Ze względu na niekompletność znalezisk trudno jednak te rauizuchy zaklasyfikować do wydzielonych powyżej linii rozwojowych. Jednakże kształt kości szczękowej oraz masywność kości strzałkowej u formy z formacji Argana wskazują na powiązanie jej z linią, rauizuchów z Ameryki Południowej. Są przesłanki, by także tikizucha opisanego z Indii zaliczyć do tej linii. Jeśli dalsze badania potwierdzą przedstawione przypuszczenia istniałyby dwie osobne linie rauizuchów: występująca na Laurazji oraz na Gondwanie.
Prawdopodobnie rauizuchidy pochodzą z Azji, najstarszy z nich został bowiem opisany z wczesnego triasu europejskiej części Rosji na podstawie kręgu szyjnego (Gower & Sennikov 2000). Mógł mieć najwyżej 1,5 metra długości. Nie jesteśmy jednak w stanie powiedzieć kiedy i gdzie nastąpiło rozdzielenie linii rozwojowych rauizuchidów.
Literatura
Barberena, M. C., 1978. A huge thecodont skull from the Triassic of Brazil. Pesquisas 9, 62-75.
Bonaparte, J. F. 1981. Description de "Fasolasuchus tenax" y su significado en la sistematica y evolucion de los Thecodontia. Revista del Museo Argentino de Ciencias Naturales "Bernardino Rivadavia" 3(2), 55-101.
Bonaparte, J. F. 1984. Locomotion in rauisuchid Thecodonts. Journal of Vertebrate Paleontology 3(4), 210-218.
Chatterjee, S. 1982. Phylogeny and classification of thecodontian reptiles. Nature 295, 317-320.
Chatterjee, S. 1985. Postosuchus, a new thecodontian reptile from the Triassic of Texas and the origin of Tyrannosaurs. Philosophical Transactions of the Royal Society London B 309, 395-460.
Dutuit, J-M. 1979. Un pseudosuchien du trias continental marocain. Annales de Paléontologie 65, 55-71.
Dzik, J. 2001. A new Paleorhinus fauna in the Early Late Triassic of Poland. Journal of Vertebrate Paleontology 21, 625-627.
Galton, P. M. 1985. The popsaurid thecodontian Terotosaurus suevicus V. Meyer, plus referred specimens mostly based on prosauropod dinosaurs, from the Middle Stubensandstein (Upper Triassic) of Nordwürttemberg. Stuttgarter Beiträge zur Naturkunde B 116, 1-29.
Gower, D. J. 1999. The cranial and mandibular osteology of a new rauisuchian archosaur from the Middle Tiassic of southern Germany. Stuttgarter Beiträge zur Naturkunde B 280, 1-49.
Gower, D. J. 2000. Rauisuchian archosaurs (Reptilia, Diapsida): An overview. Neues Jahrbuch für Geologie und Paläontologie, Abhandlungen 218, 447-488.
Gower, D. J & Sennikov, A. G. 2000. Early archosaurs from Russia. In: Benton, M.J., Kurochkin, E. N., Shishkin, M. A. & Unwin, D. M. (eds) The age of dinosaurs in Russia and Mongolia; London.
Krebs, B. 1965. Die Triasfauna der Tessiner Kalkalpen XIX. Ticinosuchus ferox nov. gen. nov. sp. Schweizerische Paläontologische Abhandlungen 81, 1-140.
Long, R. A. & Murry, P. A. 1995. Late Triassic (Carnian and Norian) tetrapods from the southwestern United States. Bulletin of the New Mexico Museum of Natural History and Science 4, 1-254.
Meyer, H. V. 1861. Reptilien aus dem Stubensandstein des obern Keupers. Paleontogaphica A 6, 253-346.
Reig, O. A. 1958. Primeros datos descriptivos sobre nuevos reptiles arcosaurios del Triassico de Ischigualasto (San Juan, Argentina). Revista de la Asociación Geológica Argentina 3(4) 257-270.
Romer, A. S. 1971. The Chanares (Argentina) Triassic reptilie fauna. VIII. A fragmentary skull of large thecodont, Luperosuchus fractus. Breviora 373, 1-8.
Sereno, P. C. 1991. Basal archosaurs: Phylogenetic relationship and functional implications. Journal of Vertebrate Paleontology 11 (supplement 4), 1-53.
Ewolucja kapitozaurów
DOROTA MAJER
Uniwersytet Opolski
Kapitozaury są dużą grupą labiryntodontów, która pojawiła się we wczesnym triasie (Parotosuchus; Griesbachian/Dienerian) w południowo-zachodniej Gondwanie (Warren 1980, Warren & Hutchinson 1988, Warren & Schroeder 1995) i wyginęła pod koniec triasu. Największy ich rozkwit przypadł na środkowy i późny trias.
Taksonomia i ewolucja kapitozaurów jest wciąż niejasna. Pierwsze wydzielenia taksonomiczne oparte były na budowie kręgosłupa, która nie odzwierciedla jednak pokrewieństw między zwierzętami. Do kapitozaurów bywają zaliczane również pierwotne formy przez innych klasyfikowane w rodzinach Benthosuchidae czy Rhinesuchidae, rodzina bywa też zawężana do rodzajów z grupy Eryosuchus i Paratosuchus. Do Benthosuchidae tradycyjnie były zaliczane mastodonzaury, głównie z powodu podzielonego przedniego wcięcia podniebiennego i budowy kanału na lacrimale. Schoch & Milner (2000) argumentują jednak, że te dwie cechy wykazują dużą zmienność, nawet gatunkową i nie można ich uznać za apomorfie. Bliskie pokrewieństwo pomiędzy Heylerusaurinae a innymi cyklotozaurami udowadnia z kolei niedawne odkrycie nowego gatunku z Arizony, który łączy cechy heylerozaurów, stentozaurów i cyklotozaurów. Kapitozaury ewolucyjnego pnia (Rewanobatrachus, Edingerella, Odenwaldia) nie wykazują niektórych cech charakterystycznych dla kapitozaurów, ale do kapitozaurów raczej niż trematozaurów kwalifikuje je budowa wcięcia usznego i obecność poprzecznego rzędu zębów (ryc. 1). Paratosuchidae są pierwotną grupą i tylko jedna cecha jest ich autapomorfią - wąskie nozdrza. Eryosuchidy i mastodonsauridy łączy wysoki poziom skostnienia czaszki (mózgoczaszka, epipterygoid) i podzielone wcięcie podniebienne. Paracyclotosauridae mają tylną część czaszki i policzek rozrośnięte do tyłu, potylica jest stosunkowo niska. Cyklotozaury są najbardziej rozwiniętą grupą kapitozaurów. Mają jeden szew więcej - pomiędzy tabulare a squamosum oraz całkowicie zamknięte wcięcie uszne.
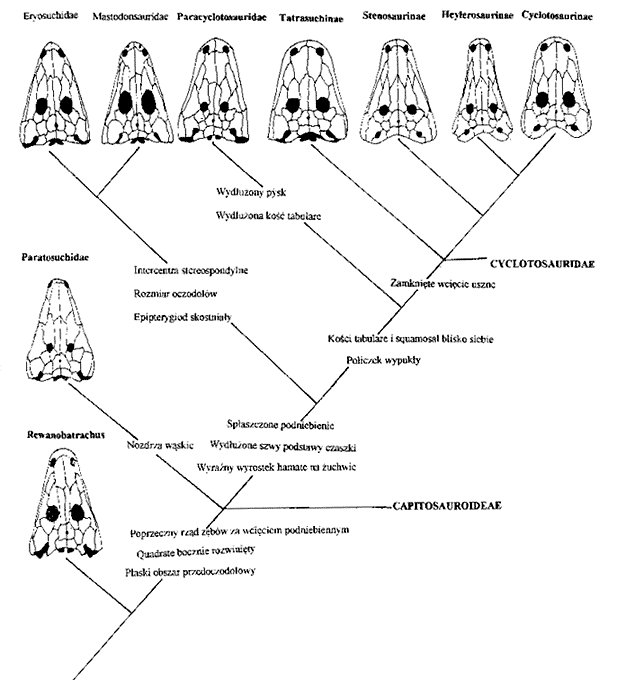 |
Ryc. 1. Filogeneza kapitozaurów wg Schoch & Milner (2000) |
W trakcie ewolucji kapitozaurów przemianom podlegała przede wszystkim czaszka (ryc. 1). Mimo różnic w budowie czaszek jest kilka cech wspólnych dla wszystkich kapitozaurów, m.in.: znaczne wydłużenie części przedoczodołowej, udział jugale w budowie oczodołu, Z-kształtna linia naboczna na lacrimale, i supratemporale nie uczestniczące w krawędzi wcięcia usznego. Czaszka Paratosuchidae była wąska, z małymi oczodołami w tylnej części, czaszka Mastodonsauridae zaś wąsko-trójkątna, ale z dużymi oczodołami, wydłużonymi kośćmi parietale, postorbitale i postfrontale, silnie skostniałym epipterygoidem. Czaszka Eryosuchidae ma cechy pośrednie pomiędzy Mastodonsauridae i Parotosuchidae, wcięcie podniebienne bywa podzielone, oczodoły większe niż u innych kapitosaurów, ale mniejsze niż u mastodonzaurów. U Paracyclotosauridae obszar zaoczodołowy czaszki jest silnie rozwinięty, pysk jest wąski, wklęsła krawędź tylna. Stenotosaurinae mają czaszkę trójkątną, z szeroką częścią policzkową i wąskim pyskiem. Dla Heylerosaurinae charakterystyczna jest czaszka z silnie rozszerzoną częścią zaoczodołową. Stosunkowo niedawno odkryta czaszka Tatrasuchinae podobna jest do Cyclotosaurinae, ale ma nie całkiem zamknięte wcięcie uszne. Cyclotosaurinae cechuje szeroka czaszka z okrągłymi lub owalnymi nozdrzami.
Przodek kapitozaurów miał zapewne otwarte wcięcia uszne, małe okna podniebienne, krótką podstawę pterygoidu, exooccipitale nie połączone z pterygoidem, pterygoid stykał się z palatinum, exooccipitale kończyło się za oknem owalnym, basisphenoid był skostniały, frontale nie tworzyło krawędzi oczodołu, zęby na pterygoidzie i parasphenoidzie, kość kwadratowa była rozrośnięta do tyłu, a epipterygoid był mały.
Zmienności niektórych cech w czasie wykazuje generalną tendencję (Welles & Cosgriff 1965) do (1) obniżania wysokości czaszki, (2) zmniejszania się odległości między oczodołami, (3) zmniejszania się odległość między wcięciami usznymi, (4) przesuwania oczu do przodu a (5) otworu ciemieniowego do wcięcia usznego oraz (6) zwężania i wydłużania podstawy pterygoidu.
Maryańska i Shiskin (1996) twierdzili, że cyklotozaury są bardzo pierwotną grupą i umieszczają je jako jedną z pierwszych odgałęzień ewolucyjnych drzewa rodowego kapitozaurów. Watson (1958) wyróżnił dwie linie ewolucyjne cyklotozaurów. Pierwsza zmierzała w kierunku płaskiej czaszki, ktora nie miała crista obliqua na pterygoidzie. Zaliczył tu tzw. prawdziwe cyklotozaury: C. robustus, C. posthumus, C. mordax i C. ebrachensis. Drugą linię rozwojową stanowią gatunki z wysoką czaszką i crista obliqua Paracyclotosaurus davidi, P. hemprichi, Cyclotosaurus statonensis. Uznał więc, że Cyclotosaurus statonensis, mimo podobieństwa anatomicznego do pozostałych cyklotozaurów, nie jest z nimi blisko spokrewniony.
Nowych informacji pogłębiających wiedzę o ewolucji cyklotozaurów dostarczają okazy znalezione w Krasiejowie. Ciekawą cechą gatunku z Krasiejowa jest znaczne wydłużenie pterygoidu, kości kwadratowej i tabulare do tyłu, co powoduje, że staw żuchwowy jest widoczny z góry i wystaje poza dach czaszki. Jest to pierwotna cecha nie spotykana u cyklotozaurów znanych do tej pory.
Literatura
Maryańska, T. & Shishkin, M.A. 1996. New cyclotosaurid (Amphibia: Temnospondyli) from the Middle Triassic of Poland and some problems of interrelationships of capitosauroids. Prace Muzeum Ziemi 43, 53-83.
Schoch, R.R. & Milner, A.R. 2000. Handbuch der Paläoherpetologie. 3B, Stereospondyli. Stem-stereospondyli, Rhinesuchidae, Rhytidostea, Trematosauroidea, Capitosauroidea. 1-164. Verlag Dr. Friedrich Pfeil, Miasto.
Warren, A.A. 1980: Parotosuchus from the early Triassic of Queensland and Western Australia. Alcheringa 4, 25-36
Warren, A.A. & Hutchinson, M.N., 1988: A new capitosaurid amphibian from the early Triassic of Queensland and the ontogeny of the capitosaurs. Paleontology 31, 857-876.
Warren, A.A. & Schroeder, N. 1995. Changes in the capitosaur skull with growth: an extension of the growth series of Parotosuchus aliciae (Amphibia, temnospondyli) with comments on the otic area of capitosaurs. Alcheringa 19, 41-46
Watson, D.M.S. 1958. A new labirynthodont (Paracyclotosaurus) from the Upper trias of New South wales. Bulletin of the British Museum, Natural History (Geology) 7, 233-263
Welles, S.P. & Cosgriff, J. 1965, A revision of labirynthodont family Capitosauroidae and a description of Parotosaurus peabodyi n. sp. from the Wupatki Member of the Moenkopi Formation of northern Arizona. 1-150. University of California Press, Berkeley and Los Angeles.
Ewolucja metopozaurów
MAŁGORZATA BEDNARZ
Uniwersytet Jagielloński
W grupie trematozauroidów (Schoch & Milner 2000), której ostatnim ogniwem była rodzina Metoposauridae, ewolucja nakierowana była (przeciwnie jak w rodzinie Trematosauridae) na wzrost szerokości czaszki. Stawała się ona stopniowo także bardziej zaokrąglona w zarysie. Ponadto czaszki tych temnospondyli stawały się płaskie, a oczodoły stopniowo przesuwały się do przodu, osiągając maksimum tego stanu właśnie u metopozaurów. Metopozaury są przystosowane do życia - podobnie jak wszystkie Trematosauridea - w środowisku wodnym, z tą różnicą, że aktywność metopozaurów była najprawdopodobniej mniejsza. Jak powstały metopozaury dokładnie nie wiadomo. Stawiano hipotezy łączące metopozaury z brachyopidami czy Trimerorhahis (Shishkin 1973) lecz po odkryciu Almasaurus (Dutui 1972) stało się jasne, że najbardziej prawdopodobnym przodkiem metopozaurów był trematozauroid almazauropodobny.
Almazaury znane są z dwóch lokalizacji: z Lettenkeuper (ladyn) w południowych Niemczech (nienazwany dotąd almazaur) oraz formacji Maleri (karnik) w Maroko (Almasaurus habbazi). Nie jest wykluczone, że almazaur dał początek pierwszym metopozaurom, których przodek musiał się pojawić przed początkiem karniku - w środkowym triasie.
Metopozaury były kosmopolityczne. Tak rozległe rozprzestrzenienie jest rzadkie wśród temnospondyli. W czasie swojego występowania (późny karnik - noryk) były pod tym względem jedyne wśród podobnych płazów. Istotne do rozróżniania gatunków w rodzinie Metoposauridae, badania pokrewieństwa czy też analizy ewolucji metopozaurów są cechy budowy czaszki, obręczy barkowej oraz kręgosłupa. Hunt (1993) uznał następujące cechy za ważne taksonomicznie:
1. Pozycja maxilli i oczodołu. U M. ouazzoui maxilla wkracza na krawędź oczodołu. Maxilla pozostałych metopozaurów jest wyłączona z granicy oczodołu poprzez szew między jugale a tylną częścią lacrimale.
 |
Ryc. 2. Gatunki metopozaurów. Kształty czaszek i położenie lacrimale. Wg Hunt (1993). Metoposaurus diagnosticus (A), M. bakeri (B), Buettneria perfecta (C), Metopozaurus ouazoui (D), M. lyazidi (E), Apachesaurus gregorii (F). |
2. Pozycja lacrimale i nozdrzy zewnętrznych. Jedynie u M. lyazidi lacrimale włączone jest w granicę nozdrza. Cecha taka występuje też u Trimerorhachis i Dendrerpeton, dlatego też została uznana za prymitywną dla metopozaurów.
3. Pozycja lacrimale w stosunku do oczodołu. Dla metopozaurów prymitywne jest wyłączenie lacrimale z krawędzi oczodołu.
4. Kształt wcięć usznych. Generalnie można zauważyć u przedstawicieli metopozaurów zróżnicowanie w zarysie tyłu czaszki. Uznano, że głębokie wcięcie jest dla metopozaurów prymitywną cechą.
5. Ornamentacja claviculi. U metopozaurów europejskich, w tym też u gatunku z Krasiejowa (M. diagnosticus) obszar obejmujący rowki jest znacznie mniejszy niż u amerykańskich.
6. Struktura kręgów. Wobec tego, że metopozaury były z całą pewnością zwierzętami całkowicie wodnymi trudno uzasadnić całkowite skostnienie trzonów kręgów (Sulej 2001) gdyż jest to cecha rzadka nawet wśród temnospondyli lądowych. Występowanie cylindrycznego intercentrum, a więc też utrata pleurocentrum jest wyrazem zaawansowania ewolucyjnego. Wyjątkiem od opisanej reguły jest M. ouazzoui mający skostniałe pleurocentra w tylnej części odcinka tułowiowego i w części ogonowej.
W próbach odtworzenia ewolucji metopozaurów wewnątrz samej rodziny Metoposauridae bierze się pod uwagę (oprócz koordynat czasowych i przestrzennych) głównie położenie lacrimale względem krawędzi oczodołu. Na podstawie tej cechy Milner (1994) wywnioskował możliwy kierunek przemian - lacrimale stopniowo przesuwało się coraz bliżej oczodołu, aż weszło w skład jego granicy. Początkowo lacrimale było oddzielone od krawędzi oczodołu przez szef jugale-praefrontale i było czworokątne. Następnie lacrimale stało się cieńsze i dłuższe, natomiast szew jugale-praefrontale zmniejszył się. Później nastąpiło włączenie lacrimale w krawędź oczodołu.
Przy powyższym założeniu można pokusić się o stworzenie poniższego modelu ewolucji w obrębie rodziny Metoposauridae:
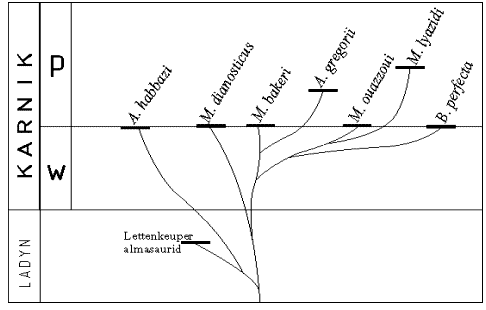 |
Ryc. 5. Model następstwa ewolucyjnego w obrębie rodziny Metoposauridae. Poziome odcinki oznaczają czas pierwszego udokumentowanego pojawienia się. |
Metopozaury były zwierzętami kosmopolitycznymi. Występowały głównie w laurazyjskiej części Pangei.
Zgodnie z przedstawionym modelem przebiegu linii ewolucyjnych (ryc. 5) początek metopozaurom dał jakiś środkowo-triasowy almazaurid związany prawdopodobnie terenie Niemiec (almazaurid z Lettenkeuper, nr 2 na ryc. 6.). Najpierwotniejszym metopozaurem zdaje się być M. diagnosticus występujący w geologicznie mlodszych warstwach tym samym regionie (nr 1 i 2 na ryc. 6). Są więc podstawy, aby upatrywać w Basenie Niemieckim początków całej rodziny. Oznacza to założenie istnienia hipotetycznych metopozaurów środkowo-triasowych w Europie. Stąd pierwsze metopozaury miałyby migrować na południowy zachód Pangei. Najbliżej w tę stronę znajduje się lokalizacja metopozaura z Kanady (M. bakeri, nr 3 na ryc. 6), którego znaleziono również w Teksasie (nr 7 na ryc. 6). Być może pokrewny mu jest młodszy A. gregorii, który również występuje w tych rejonach Ameryki Północnej (nr 5, 6, 7 na ryc. 6). U tego gatunku obserwuje się znaczne zmniejszenie rozmiarów ciała. Lacrimale nie jest włączone w krawędź oczodołu. Ponadto oczodoły u tego rodzaju są wyraźnie relatywnie mniejsze niż u pozostałych metopozaurów. Jest to cecha o dużym znaczeniu w interpretacji przystosowania do środowiska życia. Duże oczodoły to cecha z przedstawicielem tej grupy odnalezionym na odróżniająca metopozaury (oczywiście chodzi o osobniki dorosłe) od innych temnospondyli. Jest to zapewneprzejaw pedomorfozy, gdyż taką cechę obserwuje się u form młodocianych kręgowców, a ponadto krawędź oczodołów jest tu budowana przez wiele kości. Utrzymanie tej cechy przez formy dorosłe metopozaurów to być może skutek doboru, który promował cechy form juwenilnych bardziej związanych ze środowiskiem wodnym (Sulej 1998). A. gregorii jest przykładem innego trendu ewolucyjnego - wykazuje przystosowania do życia w bardziej lądowych warunkach. Potwierdzeniem tej tezy jest to, że znajdowanym okazom tego rodzaju najczęściej towarzyszą zwierzęta lądowe takie jak dinozaury, rausuchidy czy sfenosuchidy.
 |
Ryc. 6. Paleogeografia karniku. Geograficzne występowanie metopozaurów: 1. Krasiejów, śląsk, 2. Schilfsandstain, Blasensandstain i Lehrbergschichten, Niemcy, 3. Formacja Wolfville, Nowa Szkocja, Kanada. 4. Formacja Popo Agie, Wyoming, USA. 5. Formacja Petrified Forest, Arizona. 6. Formacje: Santa Rosa, Garita Creek, Bull Canyon i Redonda, Nowy Meksyk, USA. 7. Formacja Dockum, Teksas, USA. 8. Formacja Argana, Maroko, 9. Formacja Maleri, Indie. |
Można założyć, że formy M. bakeri z Kanady przedostały się na południe, ewoluując w formy M. ouazzoui odnalezione w Maroku (nr 9 na ryc. 6). M. ouazzoui był przodkiem M. lyazidi, który występuje także w Maroku, w tej samej formacji, ale w wyższej pozycji stratygraficznej. Jedyny problem to jak interpretować istnienie u M. ouazzoui skostniałego pleurocentrum.
Być może podczas migracji form pośrednich między M. bakeri a M. ouazzoui z Kanady i Ameryki Północnej na południe i na wschód oddzieliła się linia metopozaurów wiodąca do rodzaju Buettneria (nr 4, 5, 6, 7 i 9 na ryc. 6).
Literatura
DeFauw, S. L. 1989. Temnospondyl amphibians: a new perspective on the last phases in the evolution of the Labirynthodontia. Michigan Academician 21, 7-32.
Hunt, A.P. 1993. Revision of the Metoposauridae (Amphibia: Temnospondyli) and description of a new genus from western North America. In: M. Morales (ed.) Aspects of Mesosoic Geology and Paleontology of the Colorado Plateau. Museum of Northern Arizona Biulletin 59, 67-97.
Milner, A.R. 1990. The radiation of temnospondyl amphibians. In: P.D. Taylor & G.P. Larwood (eds) Major Ewolutionary Radiations. 5-25. Cambridge University Press, Cambridge.
Schoch, R. R., 2000. Biogeography of stereospondyl amphibians. Neues Jahrbuch für Geologie und Paläontologie, Abhandlungen 215, 201-231.
Schoch, R. R. & Milner A.R., 2000. Handbuch der Paläoherpetologie. Stereospondyli. Stem-Stereospondyli, Rhinesuchidae, Rhytidostea, Trematosauroidea, Capitosauroidea. 170 pp. Verlag Dr. Friedrich Pfeil: München.
Sulej, T. 1998. Geneza typu przystosowawczego wielkich jeziornych czworonogów późnego triasu. 00 pp. Praca magisterska, Zakład Ekologii Uniwersytetu Warszawskiego, Warszawa.
Sulej, T. 2000. Metopozaury. Paleontologiczne opróbkowywanie profili geologicznych, 27-31. Instytut Paleobiologii PAN, Warszawa.
Sulej, T. 2001. Nomenklatoryczny i taksonomiczny status podgatunku w paleozoologii kręgowców Nomenklatura taksonomiczna w paleontologii, 11- 15. Instytut Paleobiologii PAN, Warszawa.
Trendy w ewolucji fitozaurów
MARIUSZ LUBKA
Uniwersytet Wrocławski
Nie wiemy z której grupy gadów naczelnych wywodzą się fitozaury. Czasem upatruje się ich przodków wśród późnotriasowych Proterochampsidae, jednak pewne cechy budowy tych ostatnich (brak postfrontale i otworu ciemieniowego, które występują jeszcze u pierwotnych fitozaurów oraz odmienna budowa szkieletu pozaczaszkowego) dyskwalifikują je z tej roli. Jednak dwie ważne cechy - wydłużenie kości przedszczękowych oraz przesunięcie zewnętrznych otworów nosowych ku tyłowi czaszki zaznaczają się u obu wspomnianych grup, ale też u bardziej pierwotnych Proterosuchidae. Być może fitozaury są potomkami gadów zbliżonych do proterosuchidów, zaś Proterochampsidae stanowią boczne odgałęzienie tej linii rozwojowej. Wczesna (przedkarnijska) historia fitozaurów pozostaje nieudokumentowana a jedyna kontrowersyjnie datowana czaszka (Mesorhinosuchus) pochodząca jakoby z wczesnego triasu zaginęła. Zadziwiająca obfitość szczątków fitozaurów pojawia się dopiero w osadach późnego karniku. Miały już one wtedy niemal kosmopolityczne rozprzestrzenienie i dobrze wykształcone wszystkie cechy swej grupy. Na wczesnym etapie ewolucji zaznaczał się głównie silny rozrost kości przedszczękowych, czego efektem było powstanie wydłużonego rostrum. Cała historia grupy została zdominowana przez tendencje do gigantyzmu. Najstarsze formy mają już ponad cztery metry długości, ostatni przedstawiciele osiągali nawet i dwanaście metrów.
W ewolucji fitozaurów można wydzielić dwie linie: dążącą do maksymalnego wydłużenia i wydelikacenia rostrum oraz prowadzącą do powstania dużych zwierząt o masywnych rostrach polujących na spore ofiary. U korzeni obu tych linii znajduje się kosmopolityczny późnokarnijski, znany również z Krasiejowa, Paleorhinus. Jest to najprymitywniejszy znany nam rodzaj: jego nozdrza znajdują się jeszcze całkowicie przed przednią krawędzią okna przedoczodołowego. Paleorhinus polował na ryby, ale zapewne i na lądowe kręgowce średnich rozmiarów, a jego rostrum było umiarkowanej długości. W noryku pojawia się jego wyspecjalizowany potomek - gawialokształtny rodzaj Mystriosuchus charakteryzujący się bardzo wąskim i długim rostrum wyposażonym w homodontyczne uzębienie (nie licząc dobrze rozwiniętych kłowatych zębów z przodu rostrum). Jego nozdrza przewędrowały nie tylko daleko ku tyłowi (znalazły się w całości za przednią krawędzią otworów przedoczodołowych), ale też przesunęły się ku górze, ponad powierzchnię dachu czaszki. Zwieńczeniem tej linii, znanej tylko z Europy, jest nienazwany jeszcze fitozaur z Włoch (wapienie Zorzino; ?środkowy noryk) wykazujący w szkielecie pozaczaszkowym pewne specjalizacje do życia w wodzie. Wyrostki ościste jego kręgów ogonowych są wydłużone, a cały ogon był silnie bocznie spłaszczony.
Jeszcze w karniku pojawili się przedstawiciele znacznie liczniejszej i bardziej zróżnicowanej drugiej linii ewolucyjnej fitozaurów, również wywodzącej się z form zbliżonych do Paleorhinus. Stosunkowo pierwotny Angistorhinus (być może zasługujący na rozdzielenie na dwa rodzaje) zapewne wymarł bezpotomnie wraz z końcem wieku karnijskiego. Rutiodon (?późny karnik/wczesny noryk) reprezentuje gałąź wiodącą przez amerykańskiego Leptosuchus ku największym drapieżnikom swych czasów z rodzaju Smilosuchus. Tendencją tej linii, wymarłej we wczesnym noryku, było rozszerzanie i względne skracanie rostrum oraz wzrost heterodontyzmu jako wyraz przystosowania do polowania na większe ofiary. Nie brak wśród fitozaurów przykładów ewolucji równoległej. I tak, norycki Nicrosaurus i bliski mu Pseudopalatus, spokrewnione z linią rutiodontów, niezależnie od siebie ewoluowały w kierunku wydelikacenia rostrum. Co więcej, u Pseudopalatus nozdrza przesunęły się nad powierzchnię dachu czaszki, a uzębienie stało sie wtórnie niemal homodontyczne, podobnie jak u Mystriosuchus (wyniki analizy kladystycznej przedstawia te rodzaje jako taksony siostrzane). Co zastanawiające, poza wspomnianym włoskim przykładem, niewielkim zmianom podlegał szkielet pozaczaszkowy fitozaurów. Nie widać w nim ewidentnych przystosowań nawet u form typowo rybożernych (jak Mystriosuchus czy Pseudopalatus). Z nieznanych przyczyn z końcem triasu fitozaury wymarły.
Powyższy scenariusz ewolucji fitozaurów jest wciąż wstępny. Systematyka grupy nie jest stabilna; nawet pod względem liczby rodzajów (zwykle wydziela się około ośmiu). Różni autorzy zaliczają do odmiennych rodzajów nawet poszczególne okazy (dlatego też w tekście podano tylko przybliżone dane co do zasięgów czasowych rodzajów). Obraz jest zaciemniany również przez znaczną zmienność wewnątrzgatunkową.
Konwergencja w ewolucji małżów
MICHAŁ BRODACKI
Uniwersytet Warszawski
Choć od początku prób rekonstrukcji pokrewieństw organizmów zdawano sobie sprawę, że konwergencja może zacierać rzeczywiste ich stosunki, dopiero badania molekularne, jak i odkrycia nowych form kopalnych pozwoliły docenić powszechność tego zjawiska w ewolucji zwierząt i zrewidować ich systematykę (Moore & Willmer 1997).
Termin "konwergencja" obejmuje dwa nieco odmienne zjawiska. W ewolucji równoległej (parallel evolution) dwie lub więcej linii ewolucyjnych pochodzących od wspólnego przodka niezależnie od siebie uzyskują taki sam stan rozważanej cechy, wykorzystując odziedziczone po nim preadaptacje. W ewolucji zbieżnej (convergent evolution) bezpośrednio nie spokrewnione ze sobą linie upodabniają się do siebie, wytwarzając podobne adaptacje, wywodzące się od nieraz zupełnie odmiennych stanów wyjściowych (Moore & Willmer 1997 i cytowane tam źródła).
O tym, że także w ewolucji małżów musiała zachodzić konwergencja, przekonywały problemy ze stworzeniem jednoznacznej, stabilnej systematyki opartej na pojedynczych cechach morfologicznych: budowie skrzel, typie zawiasu, proporcjach wielkości mięśni-zwieraczy muszli, występowaniu syfonów (przegląd zmian poglądów na pokrewieństwa i systematykę małżów podaje Schneider 2001). Wielka liczba rodzajów i gatunków zaliczanych do tej gromady przy jednoczesnej stosunkowo niewielkiej liczbie opisanych typów przystosowawczych narzuca wręcz wniosek o powszechności konwergencji wśród tych zwierząt (Falniowski 2001). Do powszechnie znanych, wręcz podręcznikowych przykładów konwergencji należy podobieństwo morfologii i trybu życia słodkowodnych racicznic Dreissena i morskich omułków Mytilus - przedstawicieli różnych grup Bivalvia, przyczepiających się bisiorem do twardego podłoża. Konwergencje pojawiają się również w obrębie jednostek taksonomicznych niższej rangi, gdzie bywają trudniejsze do zidentyfikowania jedynie na podstawie danych morfologicznych.
Cementacja pojawiła się niezależnie wśród wielu grup morskich małżów i w jednej rodzinie słodkowodnych - Etheriidae należących do Unionoida. Badania molekularne (Bogan & Hoeh 2000) wykazały, że zdolność do cementacji w tej grupie została uzyskana niezależnie co najmniej dwa razy, przez linie wywodzące się z różnych grup Unionoida.
Sphaeriidae i Corbiculidae, dwie rodziny słodkowodnych małżów łączono we wspólną nadrodzinę Corbiculoidea na podstawie podobieństwa w biologii rozwoju - młode małże inkubowane są w jamie płaszczowej samicy, przechodząc prosty rozwój bez etapu larwy. Badania molekularne (Park & Foighil 2000) wykazały brak bliższego pokrewieństwa pomiędzy tymi rodzinami, które swój charakterystyczny sposób rozwoju uzyskały zatem równolegle jako przystosowanie do specyficznego środowiska słodkowodnego.
Należące do odrębnych podgromad Solemyidae i Lucinidae to małże kopiące w osadzie przesyconym siarkowodorem. Wykorzystujące chemosyntetyzujące symbiotyczne bakterie żyjące w ich skrzelach do zaspokajania potrzeb energetycznych. Choć być może jest to cecha pierwotna, wywiedziona od wspólnych, bardzo odległych przodków obu tych grup, zdaniem Taylora & Glovera (2000) Lucinidae pochodzą raczej od płytko ryjących, filtrujących przodków, które niezależnie od Solemyidae uzyskały morfologiczne przystosowania do chemosymbiozy, możliwe do prześledzenia wśród ich kopalnych przodków.
Te i inne przykłady pokazują, że konwergencje wśród małżów przejawiają się w różnych postaciach i nie zawsze bywają łatwe do dostrzeżenia.
Literatura
Bogan, A. E., Hoeh, W. R. 2000. On becoming cemented: evolutionary relationships among the genera in the freshwater bivalve family Etheriidae (Bivalvia: Unionoida). In: E. M. Harper, J. D. Taylor & J. A. Crame (eds) The Evolutionary Biology of the Bivalvia. Geological Society, London, Special Publications 177, 159-168
Falniowski, A. 2001. Drogi i bezdroża ewolucji mięczaków. 000 pp. Polska Akademia Umiejętności, Kraków.
Moore, J. & Willmer, P. 1997. Convergent evolution in invertebrates. Biological Reviews 72, 1-60.
Park, J. K. & Foighil, D. O. 2000. Sphaeriid and corbiculid clams represent separate heterodont bivalve radiations into freshwater environments. Molecular Phylogenetics and Evolution 14 (1), 75-88.
Schneider, J. A. 2001. Bivalve systematics during the 20th century. Journal of Paleontology 75(6), 1119-1127.
Taylor, J. D. & Glover, E. A. 2000. Functional anatomy, chemosymbiosis and evolution of the Lucinidae. In: E. M. Harper, J. D. Taylor & J. A. Crame (eds) The Evolutionary Biology of the Bivalvia. Geological Society, London, Special Publications 177, 159-168.
|